Nowe publikacje
Dlaczego przeżywalność komórek fotoreceptorowych nie osiąga 100%: wyjaśnienie kluczowych mechanizmów
Ostatnia recenzja: 09.08.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
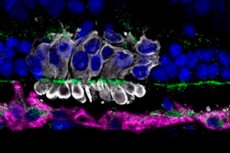
Naukowcy z Uniwersytetu Pensylwanii, pod kierownictwem Raghavi Sudharsan, odkryli, dlaczego około 70% przeszczepionych fotoczułych komórek progenitorowych (PRPC) z indukowanych pluripotentnych komórek macierzystych obumiera w ciągu pierwszych kilku dni po przeszczepieniu do siatkówki. Ich praca, opublikowana w czasopiśmie „ Stem Cell Research & Therapy”, wskazuje na stres metaboliczny w komórkach dawcy jako główną przyczynę wczesnej utraty.
Wymagania wstępne
Przeszczepienie komórek PRPC jest uważane za obiecujące podejście w leczeniu postępujących chorób zwyrodnieniowych siatkówki (retinitis pigmentosa, zwyrodnienie plamki żółtej). Jednak niski wskaźnik przeżywalności komórek dawcy ogranicza skuteczność terapii. Do tej pory główny nacisk kładziono na hamowanie odpowiedzi immunologicznej, ale nawet przy rozległej immunosupresji straty były katastrofalne.
Projekt i metody
Modele:
Zdrowym psom oraz psom z retinitis pigmentosa podawano podsiatkówkowe iniekcje fluorescencyjnie znakowanych komórek PRPC.
Oszacowanie przeżycia:
Angiografia fluoresceinowa i tomografia koherentna optyczna (OCT) rejestrowały objętość przeszczepionych komórek pierwszego, trzeciego i siódmego dnia.
Transkryptomika pojedynczej komórki (scRNA-seq):
Komórki PRPC wyizolowano z siatkówki trzeciego dnia i przeanalizowano ekspresję genów związanych z metabolizmem i apoptozą.
Immunohistochemia:
Oceniono markery stresu oksydacyjnego (4-HNE), stan mitochondriów (Tom20) i aktywację mikrogleju (Iba1) w obszarze przeszczepu.
Kluczowe wyniki
- Masowa utrata komórek: około 70% komórek PRPC zniknęło do 7. dnia, zarówno w zdrowej, jak i zwyrodnieniowej siatkówce, pomimo immunosupresji.
- Stres metaboliczny: analiza scRNA-seq wykazała drastyczny spadek ekspresji genów fosforylacji oksydacyjnej (CYCS, COX4I1) i wzrost transkrypcji markerów apoptozy (BAX, CASP3).
- Dysfunkcja mitochondriów: Immunohistochemia wykazała fragmentację i utratę znakowania Tom20 w przeszczepionych komórkach PRPC, a podwyższone poziomy 4-HNE wskazywały na uszkodzenia oksydacyjne.
- Rola mikrogleju: W obszarze przeszczepu aktywność komórek mikroglejowych Iba1⁺ wzrosła w odpowiedzi na obumarcie komórek PRPC, co mogło zaostrzyć miejscowy stan zapalny i przyczynić się do dalszych strat.
Implikacje dla terapii komórkowych
Te odkrycia zmieniają paradygmat: aby zwiększyć wchłanianie komórek PRPC, konieczne jest nie tylko stłumienie odpowiedzi immunologicznej, ale także wsparcie metabolizmu energetycznego komórek dawcy. Możliwe interwencje:
- Wstępny „metaboliczny trening wstępny” komórek PRPC w normalnych warunkach hodowli na granicy obciążenia podstresowego w celu zwiększenia odporności ich mitochondriów.
- Koktajle stabilizatorów mitochondrialnych (koenzym Q₁₀, karnityna) w trakcie i bezpośrednio po przeszczepie.
- Modulacja lokalnego mikrośrodowiska siatkówki: dostarczanie przeciwutleniaczy lub substancji chroniących mitochondria do obszaru przeszczepu.
Praktyczne wnioski i perspektywy
- Wstępne kondycjonowanie metaboliczne: kondycjonowanie komórek PRPC w warunkach łagodnego stresu metabolicznego przed przeszczepem w celu zwiększenia ich odporności.
- Dostarczanie za pomocą rusztowania: stosowanie biodegradowalnych matryc, które zapewniają stopniowe przejście komórek dawcy z bogatego środowiska hodowlanego do środowiska siatkówki.
- Wsparcie odżywcze: dostarczanie przeciwutleniaczy lub substratów oddychania mitochondrialnego w połączeniu z PRPCs.
„Długo walczyliśmy wyłącznie z barierą immunologiczną, ale teraz jest jasne, że bez rozwiązania problemu szoku metabolicznego przeszczepy są skazane na przedwczesną śmierć” – podsumowuje Raghavi Sudharsan.
Prace te, wspierane przez Narodowy Instytut Oka, otwierają drogę do skuteczniejszych terapii komórkowych, mających na celu przywrócenie wzroku pacjentom cierpiącym na zwyrodnieniowe choroby siatkówki.
