Nowe publikacje
Aktywacja odporności wrodzonej: ważna część zidentyfikowanego mechanizmu
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Naukowcy z LMU rozszyfrowali złożoną interakcję różnych enzymów wokół receptora wrodzonego układu odpornościowego, receptora typu Toll 7 (TLR7), który odgrywa ważną rolę w ochronie naszego organizmu przed wirusami.
Receptor typu Toll 7 (TLR7), zlokalizowany na komórkach dendrytycznych naszego układu odpornościowego, odgrywa kluczową rolę w naszej naturalnej obronie przed wirusami. TLR7 rozpoznaje jednoniciowe wirusowe i inne obce RNA i aktywuje uwalnianie mediatorów zapalnych. Dysfunkcje tego receptora odgrywają również kluczową rolę w chorobach autoimmunologicznych, co sprawia, że zrozumienie i, w idealnym przypadku, modulacja mechanizmu aktywacji TLR7 stają się jeszcze ważniejsze.
Naukowcy pod przewodnictwem profesora Veita Hornunga i Marlene Berouti z Genetics Centre Munich i Department of Biochemistry na LMU mogli głębiej zagłębić się w złożony mechanizm aktywacji. Z poprzednich badań wiadomo było, że złożone cząsteczki RNA muszą zostać przecięte, aby receptor mógł je rozpoznać.
Wykorzystując szereg technologii, od biologii komórkowej po kriomikroskopię elektronową, naukowcy z LMU odkryli, jak przetwarzany jest jednoniciowy obcy RNA w celu wykrycia TLR7. Ich praca została opublikowana w czasopiśmie Immunity.
W rozpoznawaniu obcego RNA biorą udział liczne enzymy
W toku ewolucji układ odpornościowy wyspecjalizował się w rozpoznawaniu patogenów na podstawie ich materiału genetycznego. Na przykład wrodzony receptor odpornościowy TLR7 jest stymulowany przez wirusowe RNA. Możemy myśleć o wirusowym RNA jako o długich pasmach cząsteczek, które są zbyt duże, aby można je było rozpoznać jako ligandy dla TLR7. Tutaj wkraczają nukleazy — narzędzia do cięcia molekularnego, które tną „pasmo RNA” na małe kawałki.
Endonukleazy przecinają cząsteczki RNA na pół, jak nożyczki, podczas gdy egzonukleazy rozcinają nić od jednego końca do drugiego. Ten proces generuje różne fragmenty RNA, które mogą teraz wiązać się z dwoma różnymi kieszeniami na receptorze TLR7. Dopiero gdy obie kieszenie wiążące na receptorze są zajęte przez te fragmenty RNA, uruchamia się kaskada sygnałowa, która aktywuje komórkę i wyzwala stan alarmowy.
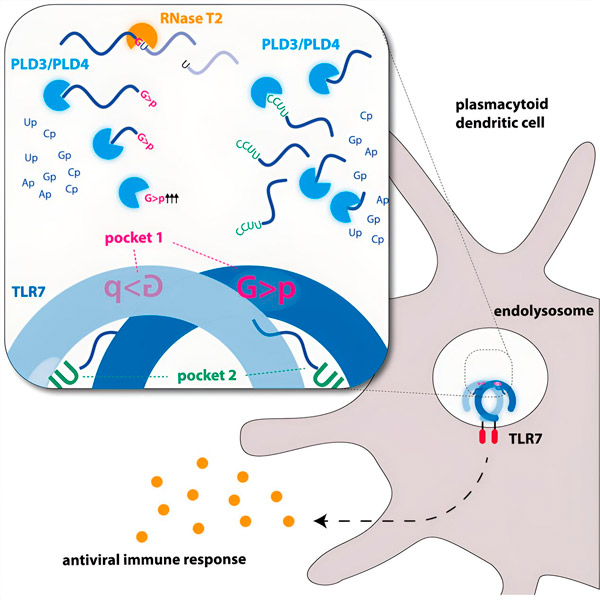
Grafika. Źródło: Immunity (2024). DOI: 10.1016/j.immuni.2024.04.010
Naukowcy odkryli, że rozpoznanie RNA TLR7 wymaga aktywności endonukleazy RNase T2, działającej w połączeniu z egzonukleazami PLD3 i PLD4 (fosfolipaza D3 i D4). „Chociaż wiadomo było, że te enzymy mogą degradować RNA”, mówi Hornung, „teraz wykazaliśmy, że oddziałują one z TLR7 i w ten sposób go aktywują”.
Równoważenie układu odpornościowego
Naukowcy odkryli również, że egzonukleazy PLD odgrywają podwójną rolę w komórkach odpornościowych. W przypadku TLR7 mają one działanie prozapalne, podczas gdy w przypadku innego receptora TLR, TLR9, mają działanie przeciwzapalne. „Ta podwójna rola egzonukleaz PLD wskazuje na subtelnie skoordynowaną równowagę w celu kontrolowania właściwych odpowiedzi immunologicznych” – wyjaśnia Berouti.
„Jednoczesna stymulacja i hamowanie stanu zapalnego przez te enzymy może służyć jako ważny mechanizm ochronny zapobiegający dysfunkcjom w systemie”. Jaka rola może odgrywać inne enzymy w tej ścieżce sygnałowej i czy zaangażowane cząsteczki nadają się jako struktury docelowe dla terapii, będzie przedmiotem dalszych badań.
