Nowe publikacje
Naukowcy stworzyli "kameleonowy" związek do leczenia lekoopornych nowotworów mózgu
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Nowe badanie przeprowadzone przez naukowców z Uniwersytetu Yale'a opisuje, w jaki sposób nowy związek chemiczny atakuje oporne na leki guzy mózgu, nie uszkadzając otaczającej go zdrowej tkanki.
Badanie opublikowane w czasopiśmie Journal of the American Chemical Society stanowi ważny krok w rozwoju tzw. „związków kameleonowych”, które mogą być stosowane w walce z szeregiem niebezpiecznych nowotworów.
Glejaki rozwijają się u około 6,6 na 100 000 osób rocznie, a u 2,94 na 100 000 osób do 14 roku życia. Wyłączając przerzuty innych nowotworów, które docierają do ośrodkowego układu nerwowego, glejaki stanowią 26% wszystkich guzów mózgu (pierwotnych guzów mózgu) i 81% wszystkich złośliwych guzów mózgu.
Przez dziesięciolecia pacjenci z glejakiem byli leczeni lekiem o nazwie temozolomid. Jednak u większości pacjentów rozwija się oporność na temozolomid w ciągu roku. Pięcioletni wskaźnik przeżycia u pacjentów z glejakiem wynosi mniej niż 5%.
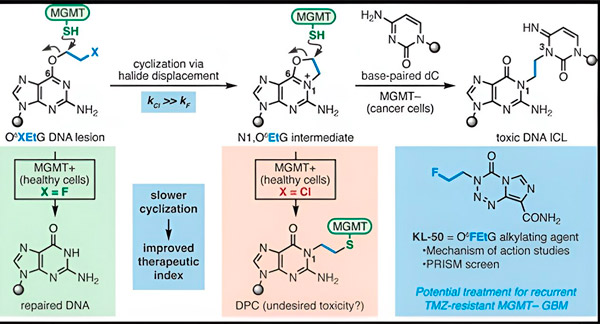
W 2022 roku chemik z Yale, Seth Herzon i radioonkolog dr Ranjit Bindra opracowali nową strategię skuteczniejszego leczenia glejaków. Stworzyli klasę cząsteczek przeciwnowotworowych zwanych związkami kameleonowymi, które wykorzystują defekt w białku naprawczym DNA znanym jako O6-metyloguanina DNA metylotransferaza (MGMT).
Wiele komórek nowotworowych, w tym glejaki, nie ma białka MGMT. Nowe związki kameleonowe są zaprojektowane tak, aby uszkadzać DNA w komórkach nowotworowych pozbawionych MGMT.
Związki kameleonowe inicjują uszkodzenia DNA poprzez osadzanie pierwotnych uszkodzeń na DNA, które z czasem ewoluują w wysoce toksyczne uszkodzenia wtórne znane jako międzyniciowe połączenia poprzeczne. MGMT chroni DNA zdrowych tkanek poprzez naprawę pierwotnych uszkodzeń zanim zdążą one ewoluować w śmiertelne międzyniciowe połączenia poprzeczne.
W swoim nowym badaniu współautorzy Herzon i Bindra skupili się na wiodącym kameleonie, KL-50.
„Wykorzystaliśmy połączenie badań z zakresu chemii syntetycznej i biologii molekularnej, aby wyjaśnić molekularne podstawy naszych poprzednich obserwacji, a także kinetykę chemiczną, która zapewnia wyjątkową selektywność tych związków” — powiedział Herzon, profesor chemii Milton Harris na Uniwersytecie Yale. „Wykazujemy, że KL-50 jest wyjątkowy, ponieważ tworzy wiązania poprzeczne DNA tylko w guzach z wadliwą naprawą DNA. Oszczędza zdrową tkankę”.
Źródło: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
To znacząca różnica, podkreślają badacze. Wiele innych związków przeciwnowotworowych zostało zaprojektowanych tak, aby wyzwalać międzyniciowe połączenia krzyżowe, ale nie są one selektywne dla komórek nowotworowych, co ogranicza ich użyteczność.
Sekret sukcesu KL-50 tkwi w jego czasie, zauważyli badacze. KL-50 tworzy międzyniciowe połączenia poprzeczne wolniej niż inne środki sieciujące. To opóźnienie daje zdrowym komórkom wystarczająco dużo czasu na wykorzystanie MGMT, aby zapobiec tworzeniu się połączeń poprzecznych.
„Ten unikalny profil sugeruje jego potencjał w leczeniu lekoopornego glejaka, obszaru o dużej niezaspokojonej potrzebie w klinice” — powiedziała Bindra, profesor radiologii terapeutycznej im. Harveya i Kate Cushing w Yale School of Medicine. Bindra jest również dyrektorem naukowym Chenevert Family Brain Tumor Center w Smilo Hospital.
Herzon i Bindra powiedzieli, że ich badanie podkreśla znaczenie uwzględnienia tempa chemicznej modyfikacji DNA i biochemicznej naprawy DNA. Wierzą, że mogą wykorzystać tę strategię do opracowania metod leczenia innych nowotworów, które zawierają specyficzne wady naprawy DNA związane z guzem.
