Nowe publikacje
Wyjaśnienie komórkowych mechanizmów zapalenia przyzębia za pomocą ulepszonego modelu zwierzęcego
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Naukowcy z Tokijskiego Uniwersytetu Medyczno-Stomatologicznego (TMDU) opracowali technikę umożliwiającą szczegółową analizę rozwoju zapalenia przyzębia na przestrzeni czasu.
Choroba przyzębia, znana jako paradontoza, jest główną przyczyną utraty zębów i dotyka prawie jedną na pięć osób dorosłych na świecie. W większości przypadków stan ten jest wynikiem reakcji zapalnej na bakteryjne zakażenie tkanek wokół zębów.
W miarę pogarszania się stanu dziąsła zaczynają się cofać, odsłaniając korzenie zębów i kość. Co ciekawe, częstość występowania zapalenia przyzębia wzrasta wraz z wiekiem, a wraz z wydłużaniem się populacji świata ważne jest, aby mieć solidne zrozumienie jego przyczyn i przebiegu.
W badaniu opublikowanym w czasopiśmie Nature Communications naukowcy z TMDU znaleźli sposób na osiągnięcie tego celu poprzez udoskonalenie powszechnie stosowanego modelu zwierzęcego do badania zapalenia przyzębia.
Bezpośrednie badanie zapalenia przyzębia u ludzi jest trudne. W rezultacie naukowcy często zwracają się do modeli zwierzęcych w badaniach przedklinicznych. Na przykład „model myszy z zapaleniem przyzębia wywołanym ligaturą” pozwolił badaczom badać mechanizmy komórkowe leżące u podstaw tego schorzenia od czasu jego wprowadzenia w 2012 r.
Mówiąc prościej, ten model sztucznie wywołuje chorobę przyzębia poprzez umieszczanie nici jedwabnych na zębach trzonowych myszy, powodując gromadzenie się płytki nazębnej. Chociaż ta metoda jest wygodna i skuteczna, nie oddaje ona pełnego obrazu zapalenia przyzębia.
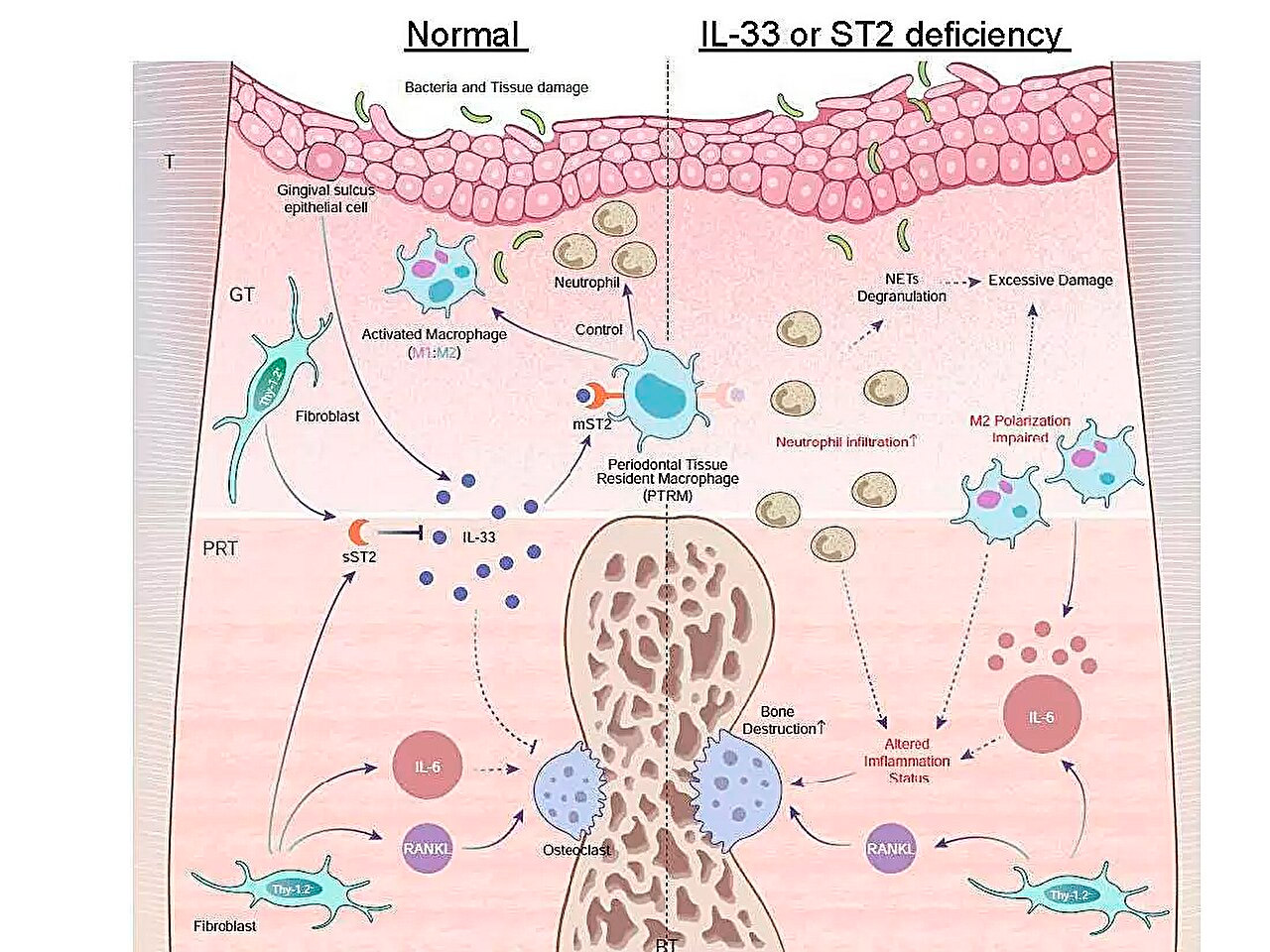
Schematyczna ilustracja profili ekspresji genów zapalnych podczas zapalenia przyzębia i roli osi IL-33/ST2 w zwalczaniu ostrego stanu zapalnego. Źródło: Tokyo Medical and Dental University.
„Chociaż tkanka przyzębia składa się z dziąsła, więzadła przyzębia, kości zębodołowej i cementu, analiza jest zazwyczaj przeprowadzana wyłącznie na próbkach dziąsła ze względu na ograniczenia techniczne i ilościowe” — zauważa główny autor badania Anhao Liu. „Ta strategia pobierania próbek ogranicza wnioski, jakie można wyciągnąć z tych badań, dlatego potrzebne są metody, które umożliwiają jednoczesną analizę wszystkich składników tkanki”.
Aby rozwiązać to ograniczenie, zespół badawczy opracował zmodyfikowany model zapalenia przyzębia wywołanego ligaturą. Zamiast klasycznej pojedynczej ligatury, zastosowali potrójną ligaturę na górnym lewym trzonowcu samców myszy. Ta strategia rozszerzyła obszar utraty kości bez znaczącego zniszczenia kości wokół drugiego trzonowca, zwiększając liczbę różnych rodzajów tkanki przyzębia.
„Wyizolowaliśmy trzy główne typy tkanek i oceniliśmy wydajność RNA między dwoma modelami. Wyniki pokazały, że model potrójnie ligowany skutecznie zwiększył wydajność, osiągając czterokrotnie większą ilość normalnej tkanki okołokorzeniowej i wspierając analizę o wysokiej rozdzielczości różnych typów tkanek” — wyjaśnia starszy autor, dr Mikihito Hayashi.
Po potwierdzeniu skuteczności zmodyfikowanego modelu naukowcy przystąpili do badania wpływu zapalenia przyzębia na ekspresję genów w różnych typach tkanek na przestrzeni czasu, skupiając się na genach związanych ze stanem zapalnym i różnicowaniem osteoklastów.
Jednym z ich kluczowych odkryć było to, że ekspresja genu Il1rl1 była znacząco wyższa w tkance okołowierzchołkowej pięć dni po podwiązaniu. Ten gen koduje białko ST2 w izoformach receptora i wabika, które wiąże się z cytokiną zwaną IL-33, która bierze udział w procesach zapalnych i immunoregulacyjnych.
Aby lepiej zrozumieć rolę tego genu, zespół wywołał zapalenie przyzębia u genetycznie zmodyfikowanych myszy, którym brakowało genu Il1rl1 lub Il33. U tych myszy zaobserwowano przyspieszone zapalne niszczenie kości, co podkreśla ochronną rolę szlaku IL-33/ST2. Dalsza analiza komórek zawierających białko ST2 w jego formie receptorowej, mST2, wykazała, że większość z nich pochodziła z makrofagów.
„Makrofagi są generalnie klasyfikowane na dwa główne typy, prozapalne i przeciwzapalne, w zależności od ich aktywacji. Odkryliśmy, że komórki ekspresujące mST2 były wyjątkowe, ponieważ jednocześnie ekspresowały niektóre markery obu typów makrofagów” — skomentował starszy autor, dr Takanori Iwata. „Te komórki były obecne w tkance okołowierzchołkowej przed rozpoczęciem stanu zapalnego, więc nazwaliśmy je „makrofagami rezydentnymi tkanki przyzębia”.
Łącznie wyniki tego badania dowodzą, że zmodyfikowany model zwierzęcy może posłużyć do bardziej szczegółowego badania zapalenia przyzębia, aż do poziomu biomolekularnego.
„Proponujemy możliwość nowej ścieżki molekularnej IL-33/ST2 regulującej stan zapalny i niszczenie kości w chorobie przyzębia, wraz ze specyficznymi makrofagami w tkance okołowierzchołkowej, które są głęboko zaangażowane w chorobę przyzębia. Mamy nadzieję, że doprowadzi to do opracowania nowych strategii leczenia i metod zapobiegania” – podsumowuje starszy autor dr Tomoki Nakashima.
