Nowe publikacje
Mutacja genu ARID1A czyni nowotwory wrażliwymi na immunoterapię
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Immunoterapia zrewolucjonizowała leczenie raka w ostatnich latach. Zamiast bezpośrednio atakować guzy, immunoterapia kieruje układy odpornościowe pacjentów, aby skuteczniej atakowały guzy. Jest to szczególnie skuteczne w przypadku niektórych trudnych do leczenia nowotworów. Jednak mniej niż połowa wszystkich pacjentów onkologicznych reaguje na obecne immunoterapie, co stwarza pilną potrzebę zidentyfikowania biomarkerów, które mogą przewidzieć, którzy pacjenci najprawdopodobniej odniosą korzyści z leczenia.
Niedawno naukowcy zauważyli, że pacjenci, u których w nowotworach występuje mutacja genu ARID1A, częściej reagują pozytywnie na blokadę punktów kontrolnych układu odpornościowego, rodzaj immunoterapii, która polega na utrzymywaniu aktywności komórek układu odpornościowego zwalczających raka.
Ponieważ mutacja genu ARID1A występuje w wielu nowotworach, w tym w raku trzonu macicy, jajnika, jelita grubego, żołądka, wątroby i trzustki, naukowcy z Instytutu Salka zastanawiali się, w jaki sposób może ona wpływać na wrażliwość na leczenie i w jaki sposób lekarze mogliby wykorzystać tę informację do personalizacji leczenia nowotworu dla każdego pacjenta.
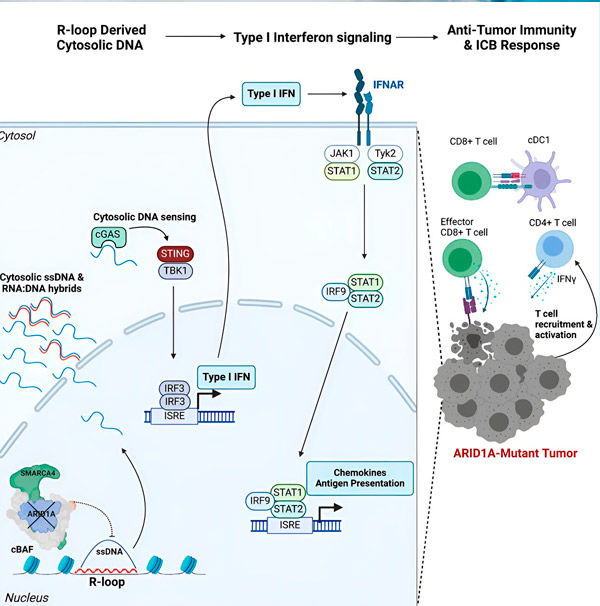
Ich nowe badanie, opublikowane w czasopiśmie Cell, pokazuje, że mutacja ARID1A sprawia, że guzy stają się wrażliwe na immunoterapię, rekrutując do guza komórki układu odpornościowego zwalczające raka za pośrednictwem odpowiedzi immunologicznej przypominającej reakcję przeciwwirusową.
Naukowcy sugerują, że tę mutację i odpowiedź immunologiczną przeciwwirusową można wykorzystać jako biomarker do lepszego doboru pacjentów do konkretnych immunoterapii, takich jak blokada punktów kontrolnych układu odpornościowego. Odkrycia te zachęcają również do opracowywania leków ukierunkowanych na ARID1A i pokrewne białka, aby uczynić inne nowotwory bardziej wrażliwymi na immunoterapię.
„To naprawdę może zmienić wynik leczenia raka u pacjentów” — powiedziała profesor nadzwyczajny Diana Hargreaves, starsza autorka badania. „Pacjenci z mutacją ARID1A mają już odpowiedź immunologiczną, więc wszystko, co musimy zrobić, to wzmocnić tę odpowiedź blokadą punktów kontrolnych układu odpornościowego, aby pomóc im zniszczyć guzy od środka”.
Chociaż wiadomo było, że osoby z mutacjami ARID1A dobrze reagowały na blokadę punktów kontrolnych układu odpornościowego, dokładny związek między nimi pozostawał niejasny. Aby rzucić światło na mechanizm, naukowcy z Instytutu Salka wykorzystali mysie modele czerniaka i raka jelita grubego zarówno z mutacją ARID1A, jak i funkcjonalnym ARID1A.
Źródło: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Zespół zaobserwował silną odpowiedź immunologiczną we wszystkich modelach z mutacją ARID1A, ale nie w tych, w których ARID1A był funkcjonalny, co potwierdza ideę, że mutacja ARID1A rzeczywiście napędza tę odpowiedź. Ale jak to działa na poziomie molekularnym?
„Odkryliśmy, że ARID1A odgrywa ważną rolę w jądrze, utrzymując prawidłową organizację DNA” — mówi Matthew Maxwell, pierwszy autor badania i student studiów podyplomowych w laboratorium Hargreavesa. „Bez funkcjonalnego ARID1A wolne DNA może zostać wycięte i uwolnione do cytozolu, aktywując pożądaną odpowiedź immunologiczną przeciwwirusową, którą można wzmocnić poprzez blokadę punktów kontrolnych układu odpornościowego”.
Gen ARID1A koduje białko, które pomaga regulować kształt naszego DNA i utrzymuje stabilność genomu. Kiedy ARID1A mutuje, uruchamia łańcuch zdarzeń w komórkach nowotworowych przypominający Rube Goldberga.
Po pierwsze, brak funkcjonalnego ARID1A powoduje uwolnienie DNA do cytozolu. Cytozolowe DNA aktywuje następnie system alarmu przeciwwirusowego, szlak cGAS-STING, ponieważ nasze komórki są przystosowane do oznaczania dowolnego DNA w cytozolu jako obcego, aby chronić przed infekcjami wirusowymi. Ostatecznie szlak cGAS-STING angażuje układ odpornościowy w rekrutację komórek T do guza i aktywację ich w wyspecjalizowane komórki T zabójców nowotworów.
Na każdym etapie, zależnym od poprzedniego, ten łańcuch zdarzeń — mutacja ARID1A, ucieczka DNA, alarm cGAS-STING, rekrutacja komórek T — prowadzi do zwiększenia liczby komórek T zwalczających raka w guzie. Blokada punktów kontrolnych układu odpornościowego może być następnie użyta do zapewnienia, że te komórki T pozostaną aktywowane, zwiększając ich zdolność do pokonania raka.
„Nasze odkrycia dostarczają nowego mechanizmu molekularnego, dzięki któremu mutacja ARID1A może przyczyniać się do odpowiedzi immunologicznej przeciwnowotworowej” — mówi Hargreaves. „To, co jest ekscytujące w tych odkryciach, to ich potencjał translacyjny. Możemy użyć mutacji ARID1A do wybrania pacjentów do blokady punktów kontrolnych układu odpornościowego, a teraz widzimy mechanizm, dzięki któremu leki hamujące ARID1A lub jego kompleks białkowy mogłyby być stosowane w celu dalszego wzmocnienia immunoterapii u innych pacjentów”.
Opisując mechanizm, dzięki któremu blokada punktów kontrolnych układu odpornościowego jest skuteczniejsza w przypadku nowotworów z mutacją ARID1A, naukowcy dostarczają klinicystom uzasadnienia dla priorytetowego traktowania tej immunoterapii u pacjentów z mutacją ARID1A. Odkrycia te stanowią ważny krok w kierunku personalizacji leczenia raka i inspirują rozwój nowych terapii ukierunkowanych na ARID1A i jego kompleks białkowy.
Zespół Instytutu Salka ma nadzieję, że w przyszłości jego odkrycia przyczynią się do poprawy wyników leczenia pacjentów z różnymi typami nowotworów powiązanymi z mutacjami ARID1A. Zamierza zbadać możliwość zastosowania tej teorii w praktyce klinicznej we współpracy z Uniwersytetem Kalifornijskim w San Diego.
