Nowe publikacje
Celiakia: nowe dowody na wpływ glutenu
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.

Dzisiaj jest Światowy Dzień Celiakii. Celiakia to przewlekła choroba autoimmunologiczna, która dotyka około 1% populacji świata. Jest spowodowana spożywaniem białek glutenowych z pszenicy, jęczmienia, żyta i niektórych rodzajów owsa. Dieta bezglutenowa chroni pacjentów z celiakią przed poważnymi uszkodzeniami jelit.
Razem ze współpracownikami, chemiczka dr Veronica Dodero z Uniwersytetu w Bielefeld była w stanie ustalić nowe szczegóły dotyczące tego, w jaki sposób pewne cząsteczki pochodzące z glutenu powodują zespół nieszczelnego jelita w celiakii.
Kluczowe odkrycie badania: pewien fragment białka wytwarzany w aktywnej celiakii tworzy nanostruktury zwane oligomerami i gromadzi się w modelowych komórkach nabłonka jelitowego. Techniczna nazwa tej cząsteczki to 33-mer deamidated gliadin peptide (DGP). Zespół badawczy odkrył, że obecność oligomerów DGP może otworzyć szczelnie zamkniętą wyściółkę jelita, prowadząc do zespołu nieszczelnego jelita.
Badanie opublikowano w czasopiśmie Angewandte Chemie International Edition.
Peptydy pszenicy powodujące nieszczelne jelita
Kiedy jemy pszenicę, nasze ciała nie są w stanie całkowicie rozłożyć białek glutenu. Może to prowadzić do tworzenia dużych fragmentów glutenu (peptydów) w naszych jelitach. W przypadku aktywnej celiakii naukowcy odkryli, że enzym zwany transglutaminazą tkankową 2 (tTG2), występujący u ludzi, modyfikuje specyficzny peptyd glutenu, co powoduje tworzenie 33-mer DGP. Zwykle ma to miejsce w części naszych jelit zwanej blaszką właściwą. Jednak ostatnie badania wykazały, że proces ten może również zachodzić w wyściółce jelit.
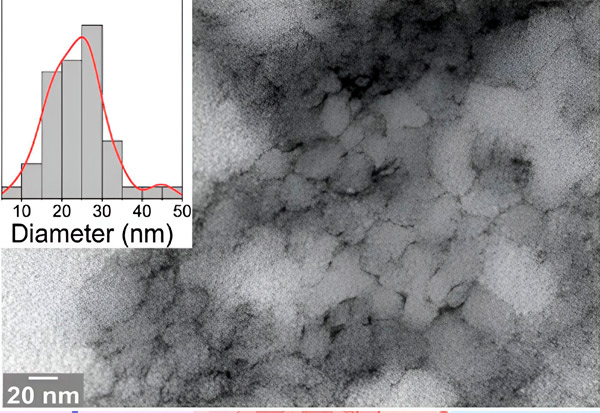
Mikrofotografia elektronowa z badania pokazuje problematyczny peptyd 33-mer DGP z ostrymi strukturami, które mogą otworzyć barierę jelitową. Źródło: Uniwersytet w Bielefeld
„Nasz interdyscyplinarny zespół scharakteryzował powstawanie 33-merowych oligomerów DGP przy użyciu mikroskopii o wysokiej rozdzielczości i metod biofizycznych. Odkryliśmy zwiększoną przepuszczalność w modelu komórek jelitowych po akumulacji DGP” — powiedziała dr Maria Georgina Herrera, pierwsza autorka badania. Jest badaczką na Uniwersytecie w Buenos Aires w Argentynie i była stypendystką podoktorską na Uniwersytecie w Bielefeld.
Gdy bariera jelitowa jest naruszona
Zespół nieszczelnego jelita występuje, gdy wyściółka jelit staje się przepuszczalna, co pozwala szkodliwym substancjom przedostać się do krwiobiegu, co prowadzi do reakcji zapalnych i różnych chorób. W przypadku celiakii toczy się debata na temat wczesnych stadiów zwiększonej przepuszczalności. Wiodącą teorią jest to, że przewlekły stan zapalny w celiakii prowadzi do nieszczelnego jelita.
Istnieje jednak druga teoria, która sugeruje, że przyczyną jest wpływ glutenu na komórki wyściółki jelitowej. Zgodnie z tym poglądem gluten bezpośrednio uszkadza komórki wyściółki jelitowej, czyniąc je przepuszczalnymi, powodując przewlekły stan zapalny i potencjalnie prowadząc do celiakii u podatnych osób.
Jednakże, ponieważ gluten jest spożywany codziennie, jakie są molekularne wyzwalacze, które prowadzą do nieszczelnego jelita u pacjentów z celiakią? Jeśli powstają oligomery 33-mer DGP, mogą uszkodzić sieć komórek nabłonkowych, umożliwiając peptydom glutenu, bakteriom i innym toksynom wyciekanie masowo do krwiobiegu, co prowadzi do stanu zapalnego, a w przypadku celiakii do reakcji autoimmunologicznej.
„Nasze odkrycia wzmacniają medyczną hipotezę, że zaburzenie bariery nabłonkowej spowodowane przez peptydy glutenu jest przyczyną, a nie skutkiem odpowiedzi immunologicznej u pacjentów z celiakią” – mówi główna autorka dr Veronica Dodero z Wydziału Chemii Uniwersytetu w Bielefeld.
Związek między 33-mer DGP a celiakią
Ludzkie antygeny leukocytarne (HLA) to białka znajdujące się na powierzchni komórek w organizmie. Odgrywają ważną rolę w układzie odpornościowym, pomagając mu odróżniać własne komórki od substancji obcych, takich jak bakterie lub wirusy.
W przypadku celiakii dwa specyficzne białka HLA, mianowicie HLA-DQ2 i HLA-DQ8, są silnie związane z chorobą. 33-mer DGP idealnie pasuje do HLA-DQ2 lub HLA-DQ8 i wyzwala odpowiedź immunologiczną, która prowadzi do stanu zapalnego i zaniku kosmków jelita cienkiego. Ta silna interakcja zamienia DGP w to, co naukowcy nazywają superantygenem. Dla osób cierpiących na celiakię dieta bezglutenowa jest jedyną terapią na całe życie.
