Nowe publikacje
Naukowcy odkryli nowy mechanizm immunosupresyjny w raku mózgu
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Docent Filippo Veglia, Ph.D., i jego zespół z Instytutu Wistar odkryli kluczowy mechanizm, dzięki któremu glejak – poważny i często śmiertelny nowotwór mózgu – tłumi odpowiedź immunologiczną organizmu, dzięki czemu guz może rosnąć niezakłócony przez mechanizmy obronne organizmu.
Ich odkrycie zostało opublikowane w artykule „Glucose-driven histone lactylation promotes the immunosupressive activity of monocyte-derived macrophages in glioblastoma” w czasopiśmie Immunity.
„Nasze badanie pokazuje, że mechanizmy samonapędzania się raka, jeśli zostaną wystarczająco zrozumiane, mogą być bardzo skutecznie wykorzystane przeciwko tej chorobie” – powiedział dr Veglia.
„Z niecierpliwością czekam na przyszłe badania mechanizmów immunosupresji zależnej od metabolizmu w glejaku wielopostaciowym i mam nadzieję, że będziemy nadal dowiadywać się więcej o tym, jak lepiej zrozumieć i zwalczać ten nowotwór”.
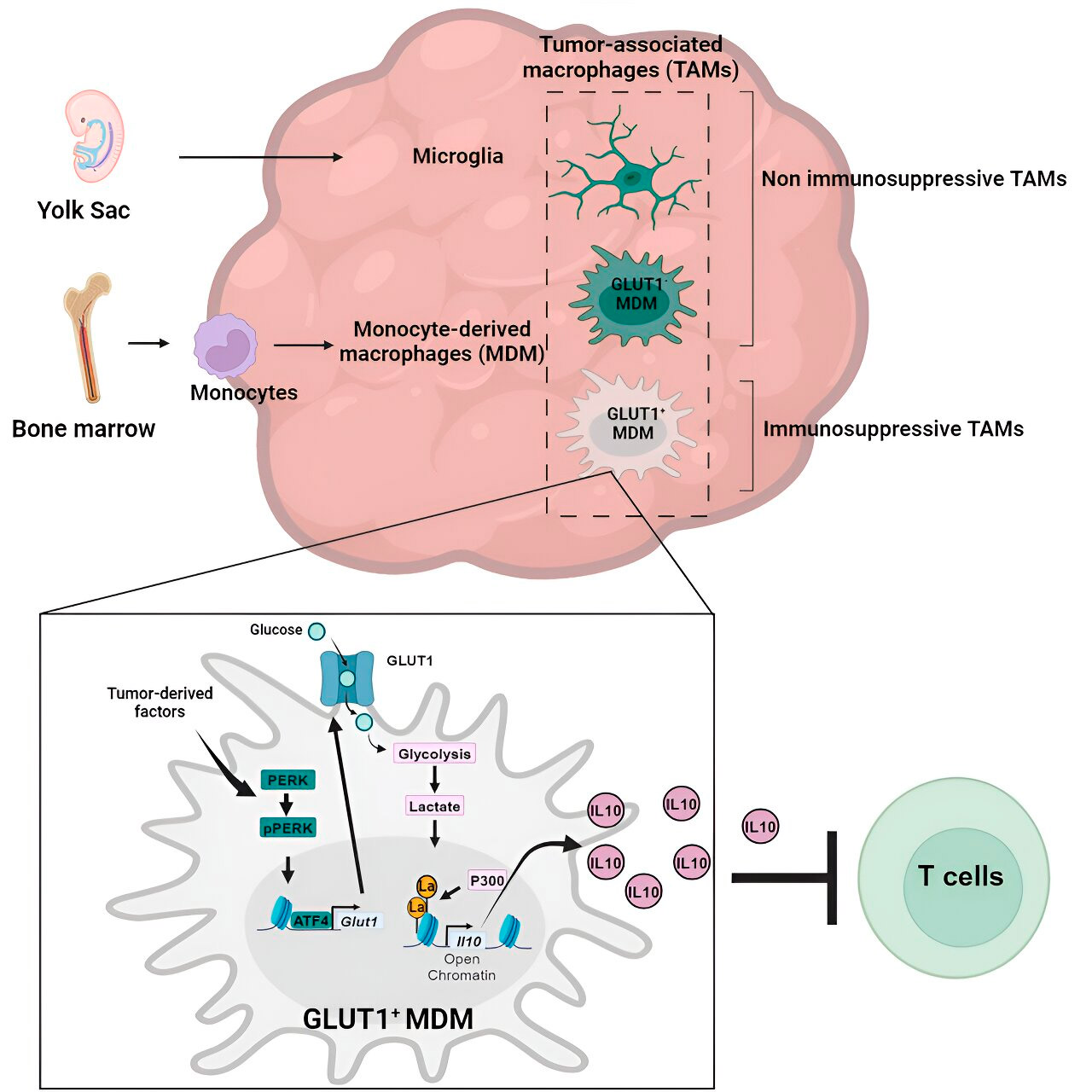
Aż dotąd niewiele zbadano, w jaki sposób makrofagi pochodzące z monocytów i mikroglej tworzą immunosupresyjne mikrośrodowisko guza w glejaku wielopostaciowym.
Laboratorium Veglii badało komórkowe mechanizmy immunosupresji w glejaku wielopostaciowym i odkryło, że w miarę postępu glejaka liczba makrofagów pochodzących z monocytów zaczyna przewyższać liczbę mikrogleju, co sugeruje, że przewaga makrofagów pochodzących z monocytów w mikrośrodowisku guza jest korzystna dla raka pod względem unikania odpowiedzi immunologicznej.
Rzeczywiście, makrofagi pochodzące z monocytów, ale nie mikroglej, blokowały aktywność komórek T (komórek odpornościowych, które zabijają komórki nowotworowe) w modelach przedklinicznych i u pacjentów. Zespół potwierdził to, oceniając przedkliniczne modele glejaka wielopostaciowego ze sztucznie zmniejszoną liczbą makrofagów pochodzących z monocytów.
Zgodnie z oczekiwaniami, modele z mniejszą liczbą złośliwych makrofagów w mikrośrodowisku guza wykazały lepsze wyniki w porównaniu ze standardowymi modelami glejaka.
Glejak wielopostaciowy stanowi nieco ponad połowę wszystkich nowotworów złośliwych, które powstają w mózgu, a rokowanie dla pacjentów zdiagnozowanych z tą chorobą jest wyjątkowo złe: tylko 25% pacjentów przeżywa pierwszy rok po diagnozie. Glejak wielopostaciowy jest niebezpieczny nie tylko ze względu na swoje umiejscowienie w mózgu, ale również ze względu na immunosupresyjne mikrośrodowisko guza, które sprawia, że glejak wielopostaciowy jest odporny na obiecujące immunoterapie.
Programując niektóre komórki układu odpornościowego, takie jak makrofagi (makrofagi pochodzące z monocytów i mikroglej), aby działały na rzecz nowotworu, a nie przeciwko niemu, glejak wielopostaciowy tworzy dla siebie mikrośrodowisko guza, które pozwala nowotworowi na agresywny wzrost, jednocześnie unikając przeciwnowotworowej odpowiedzi immunologicznej.
Wyjaśnienie mechanizmu
Po potwierdzeniu roli makrofagów pochodzących z monocytów, laboratorium Weglii starało się zrozumieć, w jaki sposób te komórki układu odpornościowego związane z rakiem działają na układ odpornościowy.
Przeprowadzili sekwencjonowanie makrofagów, aby ustalić, czy w komórkach występują jakiekolwiek nieprawidłowe wzorce ekspresji genów, które mogłyby wskazywać na geny odgrywające rolę w immunosupresji. Zbadali również wzorce metaboliczne makrofagów, aby sprawdzić, czy nieprawidłowa ekspresja genów była związana z metabolizmem.
Analiza genów i metabolizmu doprowadziła ich do metabolizmu glukozy. Seria testów wykazała, że makrofagi pochodzące z monocytów ze zwiększonym metabolizmem glukozy i ekspresją GLUT1, głównego transportera glukozy, blokowały funkcję komórek T poprzez uwalnianie interleukiny-10 (IL-10).
Zespół wykazał, że glejak zaburza metabolizm glukozy w makrofagach, wywołując ich działanie immunosupresyjne.
Laktacja histonów i jej rola
Naukowcy odkryli, że klucz do immunosupresyjnej aktywności makrofagów pochodzących z monocytów związanej z metabolizmem glukozy leży w procesie zwanym „laktylacją histonów”. Histony to strukturalne białka w genomie, które odgrywają kluczową rolę w ekspresji genów, takich jak IL-10 w określonych kontekstach.
Poprzez szybki metabolizm glukozy, makrofagi pochodzące z monocytów produkują mleczan, produkt uboczny metabolizmu glukozy. Histony mogą zostać „laktylowane” (tj. mleczan jest zintegrowany z histonami) w taki sposób, że organizacja histonów promuje ekspresję IL-10, która jest produkowana przez makrofagi pochodzące z monocytów w celu wsparcia wzrostu komórek rakowych.
Rozwiązanie problemu
Ale w jaki sposób można zatrzymać immunosupresyjną aktywność makrofagów pochodzących z monocytów związaną z metabolizmem glukozy? Dr Veglia i jego zespół zidentyfikowali możliwe rozwiązanie: PERK, enzym, który zidentyfikowali jako regulator metabolizmu glukozy i ekspresji GLUT1 w makrofagach.
W przedklinicznych modelach glejaka, ukierunkowanie leczenia na PERK zaburzyło laktylację histonów i immunosupresyjną aktywność makrofagów, a w połączeniu z immunoterapią zablokowało progresję glejaka i wywołało długotrwałą odporność, która chroniła mózg przed odrostem guza, co sugeruje, że ukierunkowanie leczenia na oś PERK-laktylacja histonów może być skuteczną strategią walki z tym śmiertelnym nowotworem mózgu.
