Nowe publikacje
Nowe mechanizmy genetyczne mogą być celem terapeutycznym przeciwko glejakowi
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Badanie przeprowadzone w laboratorium dr Shi-Yuan Cheng, profesora w Ken and Ruth Davey Division of Neuro-Oncology w Department of Neurology, zidentyfikowało nowe mechanizmy leżące u podstaw alternatywnych zdarzeń splicingu RNA w komórkach guza glejaka, które mogą służyć jako nowe cele terapeutyczne. Wyniki badania opublikowano w Journal of Clinical Investigation.
„Znaleźliśmy inny sposób leczenia glejaka, stosując metodę alternatywnego splicingu, i odkryliśmy nowe cele, które nie zostały wcześniej zidentyfikowane, ale są ważne w przypadku złośliwości glejaka” – powiedział dr n. med. Xiao Song, adiunkt neurologii i główny autor badania.
Glejaki są najczęstszym typem pierwotnego guza mózgu u dorosłych i pochodzą z komórek glejowych, które znajdują się w ośrodkowym układzie nerwowym i wspierają sąsiadujące neurony. Glejaki są wysoce oporne na standardowe metody leczenia, w tym radioterapię i chemioterapię, ze względu na genetyczną i epigenetyczną heterogeniczność guza, co podkreśla potrzebę znalezienia nowych celów terapeutycznych.
Poprzednie badania przeprowadzone w laboratorium Chenga, opublikowane w czasopiśmie Cancer Research, wykazały, że w glejakach występuje znacznie podwyższony poziom ważnego czynnika splicingowego SRSF3 w porównaniu ze zdrowymi mózgami, a regulowany przez SRSF3 splicing RNA wspomaga wzrost i progresję glejaka, wpływając na wiele procesów komórkowych w komórkach nowotworowych.
Splicing RNA to proces polegający na usunięciu intronów (niekodujących regionów RNA) i połączeniu eksonów (regionów kodujących) w celu utworzenia dojrzałej cząsteczki mRNA, która wspomaga ekspresję genów w komórce.
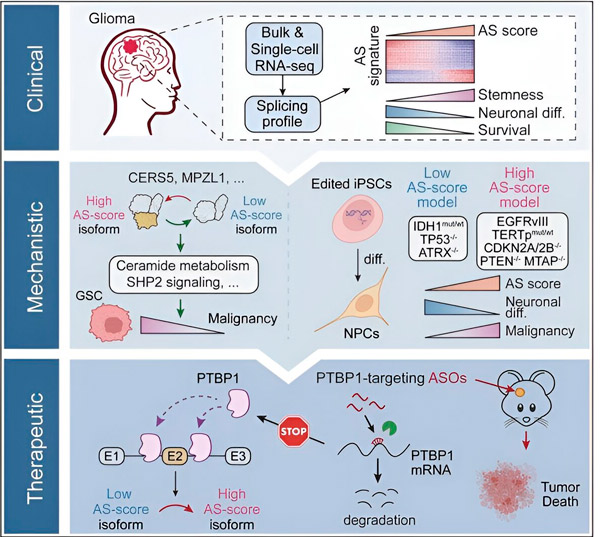
W niniejszym badaniu naukowcy chcieli zidentyfikować zmiany w alternatywnym splicingu w komórkach glejaka, mechanizmy leżące u podstaw tych zmian i określić ich potencjał jako celów terapeutycznych.
Wykorzystując metody obliczeniowe i technologie sekwencjonowania RNA, naukowcy zbadali zmiany splicingu w komórkach guza glejaka z próbek od pacjentów. Aby potwierdzić te zmiany, zastosowali technologie edycji genów CRISPR, aby wprowadzić różne mutacje napędowe glejaka do modeli glejaka pochodzących z ludzkich indukowanych pluripotentnych komórek macierzystych (iPSC).
Odkryli, że zmiany te są wzmacniane przez wariant receptora naskórkowego czynnika wzrostu III (EGFRIII), który jest nadmiernie ekspresjonowany w wielu nowotworach, w tym w glejakach, i jest hamowany przez mutację w genie IDH1.
Naukowcy potwierdzili funkcję dwóch zdarzeń splicingu RNA, które prowadzą do powstania różnych izoform białek o różnych sekwencjach aminokwasów.
„Tylko jedna z tych izoform może promować wzrost guza, w przeciwieństwie do innej izoformy, która jest normalnie wyrażana w normalnym mózgu. Guzy wykorzystują ten mechanizm, aby selektywnie wyrażać izoformę promującą guz nad izoformą normalnego mózgu” — powiedział Song.
Następnie zespół przeanalizował białka wiążące RNA w górnym biegu i odkrył, że gen PTBP1 reguluje promujący guz splicing RNA w komórkach glejaka. Korzystając z ortotopowego modelu glejaka u myszy z niedoborem odporności, naukowcy skierowali PTBP1 za pomocą terapii opartej na oligonukleotydach antysensowych (ASO), co ostatecznie zahamowało wzrost guza.
„Nasze dane podkreślają rolę alternatywnego składania RNA w kształtowaniu złośliwości i heterogeniczności glejaków oraz jego potencjalną podatność terapeutyczną w leczeniu dorosłych glejaków” – piszą autorzy badania.
Następnym krokiem dla naukowców będzie zbadanie możliwości wykorzystania PTBP1 do wywołania przeciwnowotworowej odpowiedzi immunologicznej - powiedział Song.
„Korzystając z analizy sekwencjonowania RNA o długim odczycie, odkryliśmy, że ukierunkowanie PTBP1 w komórkach glejaka skutkuje produkcją wielu transkryptów o alternatywnym splicingu, których nie ma w normalnych tkankach. Dlatego naszym kolejnym projektem jest sprawdzenie, czy ta izoforma może generować pewne antygeny, dzięki czemu układ odpornościowy może lepiej rozpoznawać guz” – powiedział Song.
Song dodał, że ich zespół jest zainteresowany analizą zmian splicingowych w komórkach nienowotworowych pochodzących od pacjentów z glejakiem, takich jak komórki układu odpornościowego.
„Wiemy już, że splicing jest bardzo ważny dla regulacji funkcji w komórce, więc powinien nie tylko regulować złośliwość guza, ale może również regulować funkcję komórek odpornościowych, aby określić, czy mogą one skutecznie zabijać raka. Dlatego przeprowadzamy również pewne analizy bioinformatyczne w komórkach odpornościowych naciekających guz, aby sprawdzić, czy następuje zmiana w splicingu po tym, jak komórka odpornościowa nacieknie guz.
„Naszym celem jest określenie roli alternatywnego splicingu w kształtowaniu immunosupresyjnego mikrośrodowiska guza i zidentyfikowanie potencjalnych celów w celu poprawy skuteczności immunoterapii w przypadku glejaka” – powiedział Song.
