Nowe badanie ujawnia kluczową rolę białek mitochondrialnych w regeneracji serca
Ostatnia recenzja: 14.06.2024

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Mitochondria odgrywają kluczową rolę w dostarczaniu energii niezbędnej do prawidłowego funkcjonowania komórek. W mitochondriach energia wytwarzana jest przez łańcuch oddechowy, który składa się z pięciu kompleksów zwanych CI-CV. Kompleksy te mogą łączyć się w superkompleksy, ale niewiele wiadomo na temat roli tego procesu i jego kontroli.
Nowe badania badają mechanizmy składania superkompleksów i ujawniają znaczący wpływ mitochondrialnych czynników składania na regenerację tkanki serca. Badaniem współprowadzili dr José Antonio Henriques z Narodowego Centrum Badań Układu Sercowo-Naczyniowego (CNIC) i dr Nadia Mercader z Uniwersytetu w Bernie w Szwajcarii, która jest naukowcem wizytującym w CNIC.
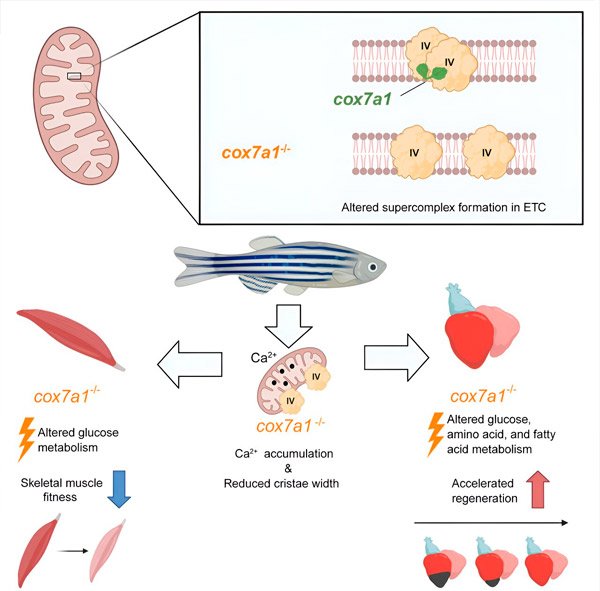
Badania opublikowane w czasopiśmie Developmental Cell pokazują, że białka należące do rodziny Cox7a odgrywają zasadniczą rolę w składaniu dimerów CIV i że to składanie ma kluczowe znaczenie dla prawidłową funkcję mitochondriów, a co za tym idzie, produkcję energii komórkowej.
Rodzina białek Cox7a obejmuje trzech członków: Cox7a1, Cox7a2 i Cox7a2l (zwanych także SCAF1). Poprzednie badania obu grup wykazały, że gdy CIV zawiera SCAF1, silnie wiąże się z CIII, tworząc superkompleks oddechowy znany jako respirasom. W tych poprzednich badaniach autorzy postawili hipotezę, że włączenie Cox7a2 spowodowałoby utworzenie CIV niekompetentnego do asocjacji, podczas gdy cząsteczki CIV zawierające Cox7a1 łączyłyby się, tworząc homodimery CIV. Nowe badanie wykazuje eksperymentalnie rolę Cox7a1 w tworzeniu homodimerów CIV.
Komórka rozwojowa (2024). DOI: 10.1016/j.devcel.2024.04.012
Pracując na modelu danio pręgowanego, naukowcy odkryli, że brak Cox7a1 zapobiega tworzeniu się dimerów CIV, a utrata tych dimerów wpływa na wagę i zdolność pływania dotkniętych ryb.
„Cox7a1 ulega ekspresji głównie w komórkach mięśni prążkowanych, a brak funkcji Cox7a1 najbardziej wpływa na tkankę mięśni szkieletowych. Innym głównym typem mięśnia poprzecznie prążkowanego jest mięsień sercowy, czyli mięsień sercowy” – wyjaśnił dr Enriquez.
Jednak chociaż utrata Cox7a1 w mięśniach szkieletowych była szkodliwa, jego brak w mięśniu sercowym poprawiał reakcję regeneracyjną serca na uraz.
„Wynik ten pokazuje, że białka te odgrywają kluczową rolę w aktywowaniu zdolności serca do regeneracji po urazie” – wyjaśnia pierwsza autorka badania, Carolina Garcia-Poyatos.
Aby lepiej zrozumieć funkcję Cox7a1, badacze z CNIC Enrique Calvo i Jesus Vazquez przeprowadzili badanie proteomiczne mięśni szkieletowych i mięśnia sercowego danio pręgowanego pozbawionego Cox7a1. Analizę tę rozszerzono o badanie metabolomiczne przeprowadzone przez kolegów z Uniwersytetu w Bernie. Ta wspólna analiza ujawniła znaczące różnice w porównaniu z niezmodyfikowanymi rybami z nienaruszoną ekspresją Cox7a1.
„Wyniki te sugerują, że cząsteczki zaangażowane w składanie superkompleksów mitochondrialnych mogą mieć znaczący wpływ na kontrolę metaboliczną, być może otwierając drogę nowym metodom leczenia chorób serca i innych schorzeń metabolicznych” – stwierdził dr Mercader.
Według zespołu badawczego odkrycie to stanowi „znaczący postęp w zrozumieniu mechanizmów komórkowych zaangażowanych w regenerację serca i może wskazać drogę do opracowania terapii mających na celu promowanie regeneracji serca”.
Autorzy doszli do wniosku, że czynniki składania mitochondriów mogą znacząco wpływać na kontrolę metaboliczną.
