Naukowcy śledzą najwcześniejsze zmiany fizyczne w komórkach, które powodują raka
Ostatnia recenzja: 14.06.2024

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Kiedy diagnozuje się raka, za nim stoi już wiele zdarzeń na poziomie komórkowym i molekularnym, które nie zostały zauważone. Chociaż rak jest klasyfikowany na wczesne i późne stadia w celach klinicznych, nawet „wczesny” etap guza jest wynikiem wielu wcześniejszych zmian w organizmie, które były niewykrywalne.
Teraz naukowcy z Yale University School of Medicine (YSM) i ich współpracownicy uzyskali szczegółową wiedzę na temat niektórych z tych wczesnych zmian, wykorzystując potężną mikroskopię o wysokiej rozdzielczości do śledzenia pierwszych fizycznych zmian, które powodują raka w komórkach skóry myszy.
Badając myszy, które są nosicielami mutacji, która promuje rozwój raka w ich mieszkach włosowych, naukowcy odkryli, że pierwsze oznaki powstawania raka występują w określonym czasie i miejscu podczas wzrostu mieszków włosowych myszy. Co więcej, odkryli, że te przedrakowe zmiany można zablokować lekami znanymi jako inhibitory MEK.
Zespół prowadził dr Tianchi Xin, adiunkt w Katedrze Genetyki YSM. W jego skład wchodziła dr Valentina Greco, profesor genetyki YSM i członek Yale Cancer Center oraz Yale Stem Cell Center, a także dr Sergi Regot, adiunkt biologii molekularnej i genetyki w Johns Hopkins School of Medicine.
Wyniki ich badań zostały opublikowane w czasopiśmie Nature Cell Biology.
Naukowcy badali myszy rozwijające się u nich nabłonkowego raka skóry, drugiego najczęstszego rodzaju raka skóry u ludzi. Te myszy zostały genetycznie zmodyfikowane, aby mieć mutację promującą raka w genie KRAS, który jest jednym z najczęściej zmutowanych onkogenów w ludzkich nowotworach. Mutacje KRAS zostały również znalezione w raku płuc, trzustki i jelita grubego.
Wczesne zmiany, które badali naukowcy, obejmowały wzrost małego, nieprawidłowego guzka w mieszku włosowym, który jest klasyfikowany jako nieprawidłowość przedrakowa. „Zrozumienie tych wczesnych zdarzeń może pomóc nam opracować podejścia zapobiegające ostatecznemu powstaniu raka” — powiedział Xin, pierwszy autor badania.
Chociaż ich badanie koncentrowało się na raku skóry, naukowcy uważają, że odkryte przez nich zasady można zastosować do wielu innych nowotworów wywołanych przez mutacje KRAS, ponieważ kluczowe geny i białka zaangażowane są takie same w różnych nowotworach.
Nie tylko proliferacja komórek Zarówno u ludzi, jak i u myszy mieszki włosowe stale rosną, pozbywając się starych włosów i tworząc nowe. Komórki macierzyste, które mają zdolność do przekształcania się w różne typy komórek, odgrywają dużą rolę w tym procesie odnowy. Poprzednie badania wykazały, że mutacje KRAS prowadzą do zwiększonej proliferacji komórek macierzystych w mieszkach włosowych, a ten znaczny wzrost liczby komórek macierzystych uważano za odpowiedzialny za przedrakowe zmiany tkankowe.
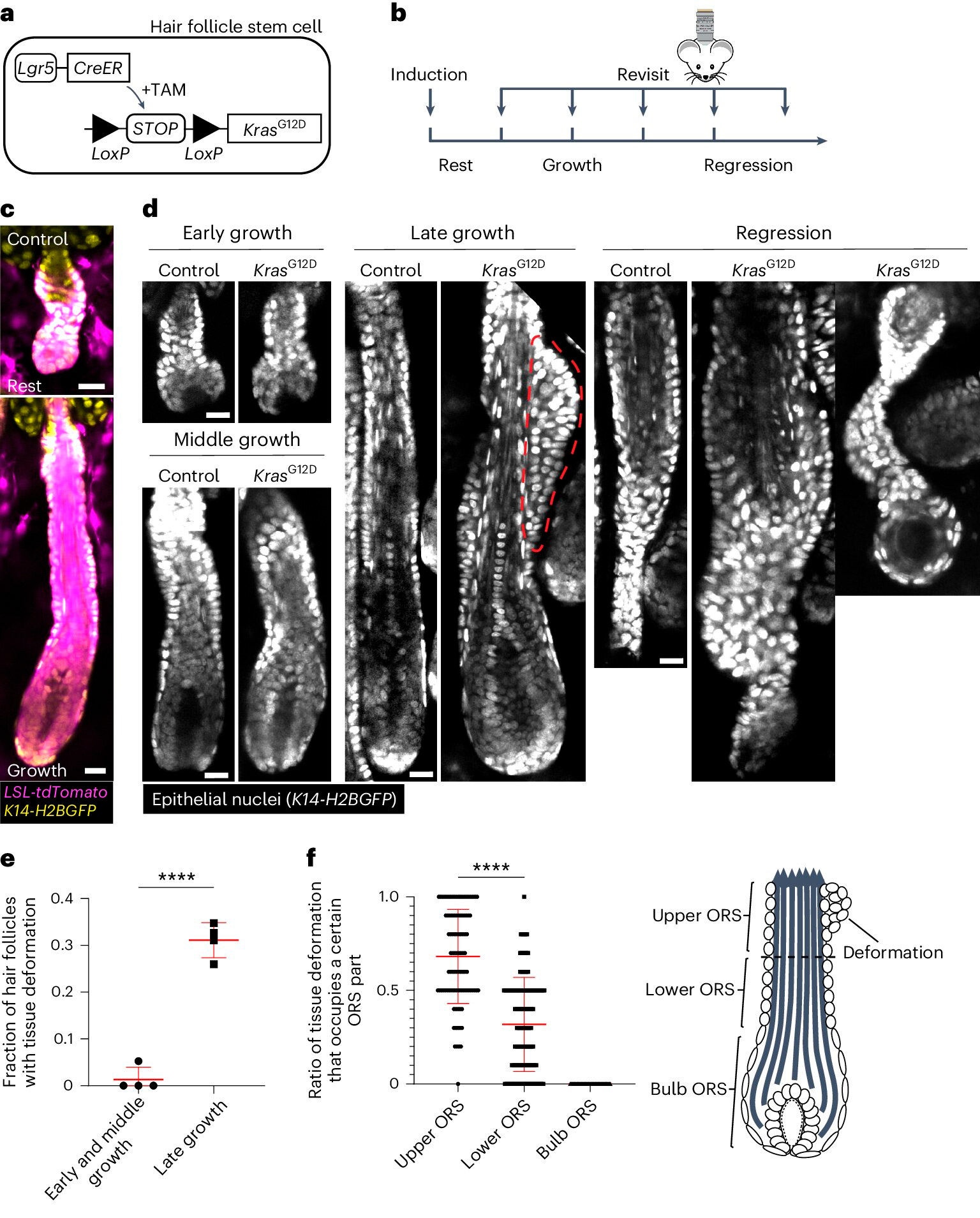
KrasG12D powoduje przestrzenno-czasowe specyficzne deformacje tkanek podczas regeneracji mieszka włosowego.
a. Schemat podejścia genetycznego do indukowania KrasG12D w komórkach macierzystych mieszka włosowego przy użyciu indukowanego tamoksifenem systemu Cre–LoxP (TAM).
b. Diagram przedstawiający czas indukcji KrasG12D i ponownego obrazowania w odniesieniu do etapów cyklu wzrostu włosa.
c. Obrazy reprezentatywne dzikiego typu spoczynkowych i rosnących mieszków włosowych zawierających indukowany reporter Cre tdTomato (Magenta) po indukcji.
d. Obrazy reprezentatywne mieszków włosowych kontrolnych i KrasG12D na różnych etapach cyklu wzrostu włosa. Deformacja tkanki w postaci guzków w zewnętrznej osłonce korzenia (ORS) jest oznaczona czerwoną linią przerywaną.
mi. Udział mieszków włosowych KrasG12D ze zdeformowaną tkanką na różnych etapach wzrostu mieszków włosowych.
F. Proporcja deformacji tkanek zajmujących górną, dolną i bulwiastą część ORS dla poszczególnych mieszków włosowych KrasG12D.
Źródło: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Aby przetestować tę hipotezę, zespół wykorzystał specjalnie zaprojektowaną formę zmutowanego genu KRAS, który mógł aktywować w określonych momentach w komórkach skóry mieszków włosowych zwierząt. Xin i jego współpracownicy zastosowali technikę mikroskopową znaną jako obrazowanie przyżyciowe, która umożliwia obrazy komórek w żywym organizmie w wysokiej rozdzielczości oraz oznaczanie i śledzenie poszczególnych komórek macierzystych u zwierząt.
Po aktywacji mutacji KRAS wszystkie komórki macierzyste zaczęły się szybciej proliferować, ale guz przedrakowy utworzył się tylko w jednym określonym miejscu mieszka włosowego i na jednym etapie wzrostu, co oznacza, że ogólny wzrost liczby komórek prawdopodobnie był to nie cała historia.
Aktywacja mutacji KRAS w mieszkach włosowych spowodowała szybszą proliferację komórek macierzystych, zmianę wzorców migracji i podział w różnych kierunkach w porównaniu z komórkami bez mutacji sprzyjającej nowotworowi.
Mutacja dotyczy białka znanego jako ERK. Xin był w stanie obserwować w czasie rzeczywistym aktywność ERK w poszczególnych komórkach macierzystych żywych zwierząt i odkrył specyficzną zmianę aktywności tego białka spowodowaną mutacją KRAS. Naukowcom udało się także zatrzymać powstawanie guza przedrakowego za pomocą inhibitora MEK, który blokuje aktywność ERK.
Lek zatrzymał wpływ mutacji na migrację i orientację komórek, ale nie na ogólną proliferację komórek macierzystych, co oznacza, że powstanie stanu przedrakowego wynika z tych dwóch pierwszych zmian, a nie zwiększonej proliferacji komórek.
Przednowotworowe zmiany w kontekście Śledzenie skutków mutacji onkogennej w czasie rzeczywistym w żywym organizmie to jedyny sposób, w jaki naukowcom udało się odkryć te zasady. Jest to ważne, ponieważ nowotwór nie powstaje w próżni – jego rozwój i utrzymanie jest w dużym stopniu zależne od mikrośrodowiska. Naukowcy musieli także śledzić nie tylko zachowanie poszczególnych komórek, ale także cząsteczek w tych komórkach.
„Podejście, jakie przyjęliśmy do zrozumienia tych onkogennych zdarzeń, tak naprawdę polega na powiązaniu różnych skal” – powiedział Greco. „Ramy i podejścia, które dr Xin zastosował we współpracy z dr Regotem, pozwoliły nam zejść do elementów molekularnych, łącząc je ze skalą komórkową i tkankową, co daje nam rozwiązanie tych zdarzeń, które tak trudno jest osiągnąć poza żywy organizm.”
Naukowcy chcą teraz śledzić ten proces przez dłuższy okres czasu, aby zobaczyć, co stanie się po powstaniu początkowych guzów. Chcą także zbadać inne zdarzenia onkogenne, takie jak zapalenie, aby sprawdzić, czy odkryte przez nich zasady mają zastosowanie w innych kontekstach.
