Nowe publikacje
Pochodne związków talidomidu prowadzą do śmierci opornych komórek nowotworowych
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Badanie przeprowadzone przez Uniwersytet Goethego we Frankfurcie wskazuje na możliwość, że pochodne talidomidu mogą być potencjalnie stosowane w leczeniu raka. Talidomid był sprzedawany jako środek nasenny w latach 50. XX wieku. Później stał się znany z powodowania poważnych wad wrodzonych na wczesnych etapach ciąży.
Wiadomo również, że cząsteczka ta oznacza białka w komórce do zniszczenia. W ramach obecnych badań naukowcy stworzyli pochodne talidomidu. Udało im się wykazać, że substancje te wpływają na zniszczenie białek odpowiedzialnych za przeżycie komórek nowotworowych.
Być może żadna inna cząsteczka nie miała tak burzliwej przeszłości jak talidomid. Był głównym składnikiem leku zatwierdzonego w wielu krajach w latach 50. jako środek uspokajający i nasenny. Jednak wkrótce stało się jasne, że kobiety w ciąży przyjmujące talidomid często rodziły dzieci z poważnymi deformacjami.
Jednak w ostatnich dekadach medycyna ponownie pokładała w nim wielkie nadzieje. Badania wykazały między innymi, że hamuje wzrost naczyń krwionośnych i dlatego potencjalnie nadaje się do odcinania guzów od ich pożywki. Następnie okazał się również bardzo skuteczny w leczeniu szpiczaka mnogiego, złośliwych nowotworów szpiku kostnego.
„Teraz wiemy, że talidomid można nazwać „klejem molekularnym”” – wyjaśnia dr Xinglai Cheng z Instytutu Chemii Farmaceutycznej Uniwersytetu Goethego we Frankfurcie. „Oznacza to, że jest w stanie uchwycić dwa białka i połączyć je ze sobą”.
Jest to szczególnie interesujące, ponieważ jedno z takich białek pełni funkcję swoistej „maszyny etykietującej”: przypisuje innemu białku jednoznaczną etykietę „ŚMIECI”.
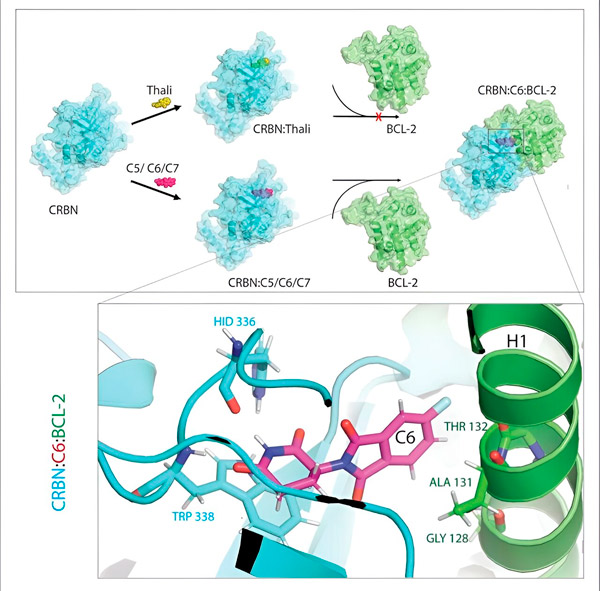
Pochodne talidomidu C5, C6 i C7 zmieniają CRBN, „maszynę znakującą”, tak aby mogła wiązać się z BCL-2. W ten sposób cząsteczka BCL-2 jest oznaczana do degradacji — możliwa nowa strategia walki z rakiem. Autor: Dr. Xinglai Cheng.
System usuwania odpadów komórki rozpoznaje ten znacznik: chwyta oznaczoną cząsteczkę białka i ją rozdrabnia. „Ten mechanizm wyjaśnia różne efekty talidomidu” — mówi Cheng. „W zależności od tego, które białko jest oznaczone, może ono powodować deformacje podczas rozwoju embrionalnego lub niszczyć złośliwe komórki”.
Ten mechanizm otwiera ogromne możliwości dla medycyny, ponieważ komórki rakowe są zależne od pewnych białek, aby przetrwać. Gdyby można je było systematycznie namierzać i rozdrabniać, być może udałoby się wyleczyć chorobę. Problem polega na tym, że klej molekularny jest dość osobliwy.
Jednym z partnerów wiążących jest zawsze maszyna do znakowania komórki, lub, w języku naukowym, ligaza E3 zwana CRBN. Tylko bardzo niewiele z wielu tysięcy białek w organizmie może być drugim partnerem — które z nich zależy od kleju.
„Stworzyliśmy więc serię pochodnych talidomidu” — mówi Cheng. „Następnie przetestowaliśmy, czy mają one właściwości adhezyjne i jeśli tak, to przeciwko którym białkom są skuteczne”. Aby to zrobić, naukowcy dodali swoje pochodne do wszystkich białek w hodowanej linii komórkowej. Następnie obserwowali, które z tych białek uległy degradacji w obecności CRBN.
„W trakcie tego procesu zidentyfikowaliśmy trzy pochodne, które mogą oznaczać białko komórkowe, które jest bardzo ważne dla degradacji, BCL-2” — wyjaśnia Cheng. „BCL-2 zapobiega aktywacji programu samozniszczenia komórek, więc jeśli go nie ma, komórki umierają”.
Dlatego BCL-2 od dawna jest przedmiotem badań nad rakiem. Istnieje nawet lek na białaczkę o nazwie venetoklaks, który zmniejsza skuteczność BCL-2, a tym samym powoduje samozniszczenie zmutowanych komórek.
„Jednak w wielu komórkach nowotworowych sam BCL-2 jest zmutowany. W rezultacie venetoklaks nie hamuje już białka” — mówi Cheng. „Udało nam się wykazać, że nasze pochodne również oznaczają tę zmutowaną formę jako degradację. Ponadto nasi partnerzy z Instytutu Biofizyki Maxa Plancka symulowali interakcję pochodnych talidomidu z BCL-2 na komputerze. Wykazało to, że pochodne wiążą się z zupełnie innymi miejscami niż venetoklaks — wynik, który później mogliśmy potwierdzić eksperymentalnie”.
Naukowcy testowali również swoje związki na muszkach owocowych z komórkami nowotworowymi. Wskaźnik przeżywalności muszek leczonych w ten sposób był znacznie wyższy. Jednak Cheng przestrzega przed zbytnim nakręcaniem nadziei, ponieważ wyniki te są nadal badaniami podstawowymi. „Chociaż pokazują, że zmodyfikowane cząsteczki talidomidu mają duży potencjał terapeutyczny, nie możemy jeszcze powiedzieć, czy sprawdzą się w praktyce w pewnym momencie”.
Wyniki badania opublikowano w czasopiśmie Cell Reports Physical Science.
