Zidentyfikowano białko odpowiedzialne za genetyczną chorobę zapalną
Ostatnia recenzja: 14.06.2024

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Zespół naukowców kierowany przez dr Hirotsugu Oda z Klastra Doskonałości CECAD ds. Badań nad Agingiem na Uniwersytecie w Kolonii odkrył rolę, jaką specyficzny kompleks białkowy odgrywa w niektórych postaciach rozregulowania układu odpornościowego. Wynik ten może doprowadzić do opracowania nowych podejść terapeutycznych mających na celu ograniczenie autoinflacji i „przywrócenie” układu odpornościowego pacjentów cierpiących na genetyczną dysfunkcję tego kompleksu białkowego.
Badanie „Biallelic ludzki SHARPIN, utrata funkcji indukuje autozapalenie i niedobór odporności” zostało opublikowane w Nature Immunology.
Liniowy kompleks składający się z ubikwityny (LUBAC), składający się z białek HOIP, HOIL-1 i SHARPIN, od dawna uznawany jest za kluczową rolę w utrzymaniu homeostazy immunologicznej. Poprzednie badania na myszach wykazały poważne konsekwencje utraty SHARPIN, prowadzące do ciężkiego zapalenia skóry w wyniku nadmiernej śmierci komórek skóry. Jednak konkretne konsekwencje niedoboru SHARPIN dla zdrowia ludzkiego pozostają jak dotąd niejasne.
Zespół badawczy po raz pierwszy zgłosił dwie osoby z niedoborem SHARPIN, które wykazują objawy autoinflacji i niedoboru odporności, ale nieoczekiwanie nie wykazują problemów dermatologicznych, jakie obserwuje się u myszy.
Po dalszym badaniu stwierdzono, że u tych osób upośledzona jest kanoniczna odpowiedź NF-κB, szlak ważny dla odpowiedzi immunologicznej. Wykazywały także zwiększoną wrażliwość na śmierć komórek spowodowaną przez członków nadrodziny czynników martwicy nowotworu (TNF). Leczenie jednego z pacjentów z niedoborem SHARPIN terapią anty-TNF, która specyficznie hamuje śmierć komórek indukowaną przez TNF, spowodowało całkowite ustąpienie autoinflacji na poziomie komórkowym i obraz kliniczny.
Badania pokazują, że nadmierna i niekontrolowana śmierć komórek odgrywa kluczową rolę w genetycznych chorobach zapalnych u ludzi. Zespół Ody dodał niedobór SHARPIN jako nowego członka grupy genetycznych ludzkich chorób zapalnych, które proponują nazwać „wrodzonymi błędami śmierci komórek”.
Ochrona przed zaburzeniami regulacji układu odpornościowego Badanie rozpoczęło się w laboratorium dr Dana Kastnera w Narodowym Instytucie Zdrowia (NIH) w Stanach Zjednoczonych. Naukowcom udało się zaobserwować jednego pacjenta, u którego w dzieciństwie wystąpiły niewyjaśnione epizody gorączki, zapalenia stawów, zapalenia jelita grubego i niedoboru odporności.
Po uzyskaniu świadomej zgody przeprowadzili sekwencjonowanie egzomu pacjenta i jego rodziny i odkryli, że u pacjenta występuje destrukcyjny wariant genetyczny w genie SHARPIN, prowadzący do niewykrywalnych poziomów białka SHARPIN. Odkryli również, że komórki pacjentów wykazywały zwiększoną skłonność do obumierania, zarówno w przypadku komórek hodowanych, jak i biopsji pacjentów.
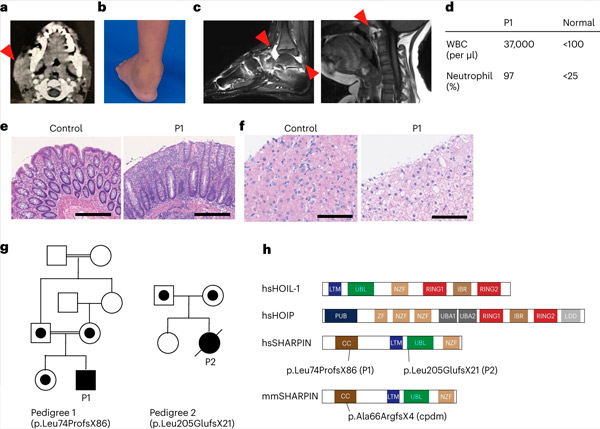
Niedobór SHARPIN u ludzi powoduje zapalenie autozapalne i glikogenozę wątroby. Źródło: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Zespół odkrył również, że rozwój limfoidalnych ośrodków rozrodczych – wyspecjalizowanych mikrostruktur w migdałkach, które mają kluczowe znaczenie dla dojrzewania komórek B naszego układu odpornościowego, a tym samym wytwarzania przeciwciał – został znacznie ograniczony z powodu zwiększonej śmierci komórek B. Wyniki te wyjaśniają niedobór odporności u pacjentów i podkreślają ważną rolę LUBAC w utrzymaniu homeostazy immunologicznej u ludzi.
„Nasze badanie podkreśla kluczowe znaczenie LUBAC w ochronie przed rozregulowaniem układu odpornościowego. Wyjaśniając mechanizmy molekularne leżące u podstaw niedoboru LUBAC, torujemy drogę nowym strategiom terapeutycznym mającym na celu przywrócenie homeostazy układu odpornościowego” – powiedziała Oda, główna autorka badania.
Dodał: „Jeden z pacjentów z niedoborem SHARPIN przez wiele lat poruszał się na wózku inwalidzkim, zanim go po raz pierwszy zobaczyliśmy. Bolały go kostki i chodzenie było zbyt bolesne. Diagnoza genetyczna pozwoliła nam wybrać właściwy szlak molekularny leżący u podstaw jego schorzeń.”
Odkąd pacjent zaczął otrzymywać terapię anty-TNF, przez prawie siedem lat nie występowały u niego objawy. „Jako klinicysta i naukowiec cieszę się, że dzięki naszym badaniom mogę pozytywnie wpłynąć na życie jednego pacjenta” – podsumowała Oda.
