Nowe publikacje
Lek LM11A-31 spowalnia postęp choroby Alzheimera w badaniu klinicznym
Ostatnia recenzja: 02.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.

W niedawnym badaniu opublikowanym w czasopiśmie Nature Medicine naukowcy przeprowadzili randomizowane, podwójnie zaślepione, kontrolowane placebo badanie fazy 2a, aby sprawdzić bezpieczeństwo i skuteczność LM11A-31 w leczeniu choroby Alzheimera (AD) poprzez modulację receptora neurotrofiny p75 (p75NTR).
Późny początek AD jest najczęstszą postacią demencji, charakteryzującą się niewydolnością synaptyczną, degeneracją i utratą komórek nerwowych. Chociaż dwa wiodące leki w leczeniu AD są ukierunkowane na gromadzenie się nieprawidłowych białek amyloidu-β lub tau, to dotyczą one tylko części patofizjologii. Inne podejście obejmuje ukierunkowanie na receptory i sieci sygnałowe, które wpływają na podstawowe szlaki biologiczne. Badania przedkliniczne pokazują, że modulacja p75NTR za pomocą nowej małej cząsteczki chemicznej, LM11A-31, zmniejsza utratę synaptyczną spowodowaną przez amyloid i nieprawidłowe tau.
Opis badania
W tym randomizowanym badaniu klinicznym naukowcy sprawdzali, czy LM11A-31 może spowolnić postęp choroby Alzheimera poprzez modulację p75NTR u ludzi.
Uczestnikom badania podawano doustne kapsułki LM11A-31 w dawkach 200 mg i 400 mg lub placebo w stosunku 1:1:1 242 pacjentom z łagodną do umiarkowanej astmą przez 26 tygodni. Uczestnicy mieli biologicznie potwierdzoną chorobę Alzheimera (poziom białka β-amyloidu 42 (Aβ42) w płynie mózgowo-rdzeniowym poniżej 550 ng/l lub stosunek Aβ42:β40 poniżej 0,89) zdiagnozowaną według kryteriów McKhanna, z wynikami Mini-Psychiatric Examination (MMSE) od 18 do 26, wynikami Geriatric Depression Scale (GDS) poniżej 5,0, wynikami zmodyfikowanej Hachinski Ischemic Scale (HIS) ≤ 4,0, formalną edukacją ≥ 8 lat i wcześniejszym pogorszeniem funkcji poznawczych ≥ 6 miesięcy.
Kwalifikujący się uczestnicy przyjmowali inhibitory acetylocholinoesterazy (AChEI) lub częściowych antagonistów receptora NMDA przez ≥ 3 miesiące przed włączeniem do badania. Nie przyjmowali nielegalnych narkotyków, takich jak leki przeciwpsychotyczne, benzodiazepiny, leki przeciwpadaczkowe, leki uspokajające, leki przeciwnadciśnieniowe o działaniu ośrodkowym, nootropiki (z wyjątkiem miłorzębu japońskiego) lub leki przeciwbólowe zawierające opioidy.
Pierwszorzędowym wynikiem badania było bezpieczeństwo i tolerancja, oceniane przy użyciu skali Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), parametrów życiowych, ciśnienia krwi i parametrów hematologicznych. Do oceny wtórnych wyników poznawczych zastosowano strukturalne obrazowanie metodą rezonansu magnetycznego (cMRI), pozytonową tomografię emisyjną z fluorodeoksyglukozą (FDG-PET) i biomarkery płynu mózgowo-rdzeniowego (CSF). Pomiary AD obejmowały Thr181-fosforylowane tau, całkowite białko tau, Aβ40, Aβ42 i aktywność AChE. Zespół zastosował dostosowany test neuropsychologiczny do oceny wtórnych wyników poznawczych na początku badania, w 12. i 26. tygodniu.
Wyniki badań
Badanie wykazało, że LM11A-31 jest bezpieczny i dobrze tolerowany, bez istotnych obaw o bezpieczeństwo. Najczęstsze działania niepożądane obejmowały ból głowy, biegunkę, eozynofilię i zapalenie nosogardła, przy czym problemy żołądkowo-jelitowe i eozynofilia były głównymi powodami przerwania leczenia. W grupie 400 mg odnotowano więcej przerwań w porównaniu z grupami 200 mg i placebo. MRI nie wykazało żadnych obaw o bezpieczeństwo, w tym nieprawidłowości związanych z amyloidem. Nie było istotnych różnic w wynikach badań poznawczych ani nieprawidłowościach amyloidowych między dwiema grupami leczonymi.
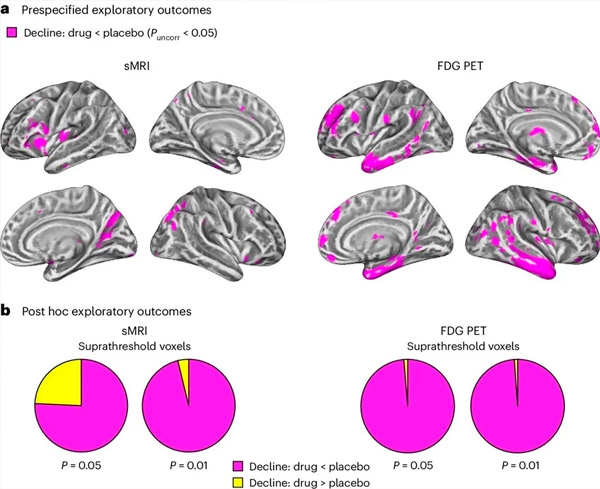
A. Dwukierunkowa analiza mieszanych modeli kowariancji badała interakcje między leczeniem (lek lub placebo) a czasem (przed lub po leczeniu). Jednostronny kontrast t badający hipotezę interakcji (lek spowalnia postęp w porównaniu z placebo) wykazał, że leczenie LM11A-31 spowolniło zwyrodnienie podłużne (panele po lewej) i hipometabolizm glukozy (panele po prawej) w grupie leku (cMRI, n = 127; PET, n = 121) w porównaniu z grupą placebo (cMRI, n = 66; PET, n = 62). Woksele pokazujące tę interakcję są pokazane przy niekorygowanym progu P < 0,05 (magenta) na powierzchni korowej specyficznej dla populacji. Lewa i prawa półkula są pokazane odpowiednio w górnym i dolnym rzędzie. Obszary mózgu pokazujące interakcje niezgodne z hipotezą są pokazane na rysunku 7 w danych uzupełniających.
B. Całkowita liczba wokseli w zdefiniowanych wcześniej podatnych na chorobę Alzheimera obszarach mózgu (całkowita powierzchnia wykresów kołowych) wykazujących interakcję zgodną z hipotezą (magenta) lub niezgodną z hipotezą (żółty) w każdej modalności obrazowania (cMRI, lewy panel; FDG PET, prawy panel) przy coraz bardziej liberalnych progach niekorygowanego P < 0,01 i P < 0,05. Symulacje Monte Carlo wykazały, że stosunki wokseli wykazujących efekty zgodne z hipotezą w stosunku do niezgodnych z hipotezą były istotnie wyższe od tych obserwowanych na podstawie losowo generowanych danych zarówno dla cMRI, jak i PET (P < 0,001 dla każdej modalności; test dwustronny).
LM11A-31 skutecznie zmniejszył wzrost CSF Aβ42 i Aβ40 w porównaniu z grupą placebo. Lek wykazał również zmniejszenie mediany rocznej procentowej zmiany w presynaptycznym białkowym biomarkerze SNAP25 i zmniejszenie postsynaptycznego biomarkera NG, co wskazuje na spowolnienie utraty połączeń presynaptycznych i postsynaptycznych. LM11A-31 zmniejszył również wzrost YKL40, co doprowadziło do zmniejszenia wyników MMSE i wzrostu wyników ADAS-Cog-13. Lek zmniejszył również utratę istoty szarej w płacie czołowym i tylnej korze ciemieniowej oraz zmniejszenie metabolizmu glukozy w takich obszarach jak kora entorhinalna, kora skroniowa, hipokamp, kora wyspowa i kora przedczołowa.
Wniosek
Badanie wykazało, że modulacja p75NTR przez LM11A-31 nadaje się do większych badań klinicznych. LM11A-31 spełnił główny punkt końcowy bezpieczeństwa i był dobrze tolerowany u pacjentów z łagodną do ciężkiej postacią AD. Wyniki wskazują na potrzebę dalszych badań z dłuższym czasem trwania leczenia w celu oceny potencjału małych cząsteczek do regulacji p75NTR jako terapii modyfikującej przebieg choroby w AD. Badanie wykazało, że LM11A-31 znacząco wpłynął na kilka biomarkerów, w tym Aβ40, Aβ42, SNAP25, NG i YKL40, co wskazuje na spowolnienie postępu patologicznego. Przyszłe badania mogą ocenić dodatkowe wskaźniki zdrowia glejowego.
