Ekspert medyczny artykułu
Nowe publikacje
Gruczoły przytarczyczne
Ostatnia recenzja: 04.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
W 1879 roku szwedzki naukowiec S. Sandstrom opisał przytarczyce u ludzi i nadał im nazwę. Przytarczyce to ważne organy. Ich funkcją jest produkcja i wydzielanie parathormonu (PTH), jednego z głównych regulatorów metabolizmu wapnia i fosforu.
Parzysta przytarczyca górna (glandula parathyroidea superior) i przytarczyca dolna (glandula parathyroidea inferior) to okrągłe lub jajowate ciała zlokalizowane na tylnej powierzchni każdego z płatów tarczycy: jeden gruczoł na górze, drugi na dole. Długość każdego gruczołu wynosi 4-8 mm, szerokość 3-4 mm, grubość 2-3 mm. Liczba tych gruczołów nie jest stała i może się wahać od 2 do 7-8, średnio jest ich cztery. Całkowita masa gruczołów wynosi średnio 1,18 g.
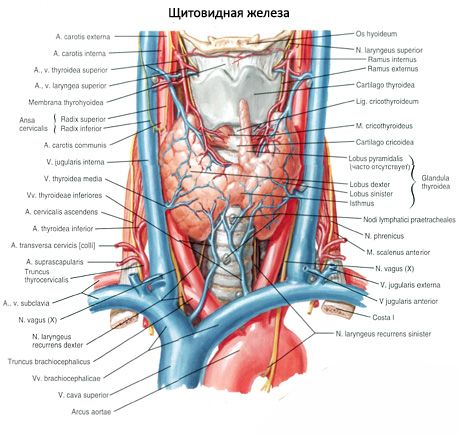
Przytarczyce różnią się od tarczycy jaśniejszym kolorem (u dzieci są bladoróżowe, u dorosłych - żółtobrązowe). Często przytarczyce znajdują się w miejscu penetracji tkanki tarczycy przez tętnice tarczowe dolne lub ich odgałęzienia. Przytarczyce są oddzielone od otaczających tkanek własną torebką włóknistą, z której do gruczołów rozciągają się warstwy tkanki łącznej. Te ostatnie zawierają dużą liczbę naczyń krwionośnych i dzielą przytarczyce na grupy komórek nabłonkowych.
Miąższ gruczołów tworzą główne i acidofilne paratirocyty, które tworzą sznury i skupiska otoczone cienkimi wiązkami włókien tkanki łącznej. Oba typy komórek są uważane za różne stadia rozwoju paratirocytów. Główne paratirocyty mają kształt wielościenny, cytoplazmę zasadochłonną z dużą liczbą rybosomów. Wśród tych komórek wyróżnia się ciemne (aktywnie wydzielające) i jasne (mniej aktywne). Paratirocyty acidofilne są duże, o wyraźnych konturach, zawierają wiele małych mitochondriów z cząsteczkami glikogenu.
Hormon przytarczyc, paratyroksyna (parathormon), jest białkiem w składzie i bierze udział w regulacji metabolizmu fosforu i wapnia. Parathormon zmniejsza wydalanie wapnia z moczem i zwiększa jego wchłanianie w jelicie w obecności witaminy D. Tyrokalcytonina jest antagonistą parathormonu.
Embriogeneza przytarczyc
Przytarczyce rozwijają się z nabłonka parzystych kieszeni skrzelowych III i IV. W 7. tygodniu rozwoju nabłonkowe zawiązki ciał oddzielają się od ścian kieszeni skrzelowych i w procesie wzrostu przemieszczają się w kierunku ogonowym. Następnie tworzące się przytarczyce zajmują dla nich stałe miejsce na tylnych powierzchniach prawego i lewego płata tarczycy.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Naczynia i nerwy przytarczyc
Dopływ krwi do przytarczyc zapewniają gałęzie tętnic tarczowych górnej i dolnej, a także gałęzie przełykowe i tchawkowe. Krew żylna wypływa przez żyły o tej samej nazwie. Unerwienie przytarczyc jest podobne do unerwienia tarczycy.
Cechy przytarczyc związane z wiekiem
Całkowita masa przytarczyc u noworodka waha się między 6 a 9 mg. W ciągu pierwszego roku życia ich całkowita masa zwiększa się 3-4 razy, w wieku 5 lat ponownie się podwaja, a w wieku 10 lat potraja. Po 20 latach całkowita masa czterech przytarczyc osiąga 120-140 mg i pozostaje stała aż do starości. W każdym wieku masa przytarczyc u kobiet jest nieznacznie większa niż u mężczyzn.
Zazwyczaj człowiek ma dwie pary przytarczyc (górną i dolną), zlokalizowane na tylnej powierzchni tarczycy, poza jej torebką, w pobliżu górnego i dolnego bieguna. Jednak liczba i lokalizacja przytarczyc może być różna; czasami można znaleźć nawet 12 przytarczyc. Mogą być zlokalizowane w tkance tarczycy i grasicy, w przednim i tylnym śródpiersiu, w osierdziu, za przełykiem, w okolicy rozwidlenia tętnicy szyjnej. Górne przytarczyce mają kształt spłaszczonego jajowatego, dolne są kuliste. Ich wymiary wynoszą w przybliżeniu od 6x3 do 4x1,5 - 3 mm, całkowita waga wynosi od 0,05 do 0,5 g, kolor jest czerwonawy lub żółtobrązowy. Dopływ krwi do przytarczyc odbywa się głównie przez gałęzie tętnicy tarczowej dolnej, odpływ żylny następuje przez żyły tarczycy, przełyk i tchawicę. Przytarczyce unerwione są przez włókna współczulne nerwów krtaniowych wstecznych i górnych, unerwienie przywspółczulne odbywa się przez nerwy błędne. Przytarczyce pokryte są cienką torebką łącznotkankową; przegrody od niej wychodzące wnikają do gruczołów. Zawierają naczynia krwionośne i włókna nerwowe. Miąższ przytarczyc składa się z paratirocytów, czyli komórek głównych, wśród których, w zależności od stopnia zabarwienia, wyróżnia się hormonalnie aktywne komórki jasne lub błyszczące, a także spoczynkowe komórki ciemne. Komórki główne tworzą skupiska, sznury i skupiska, a u osób starszych - pęcherzyki z koloidem w jamie. U dorosłych pojawiają się komórki zlokalizowane głównie na obwodzie przytarczyc, barwione eozyną - komórki eozynofilowe lub oksyfilowe, które są degenerującymi komórkami głównymi. W przytarczycach można również znaleźć formy przejściowe między komórkami głównymi i oksyfilowymi.
Pierwsze sukcesy w wyjaśnianiu zagadnień syntezy, rozszyfrowywaniu struktury, badaniu metabolizmu parathormonu osiągnięto po 1972 roku. Parathormon to jednołańcuchowy polipeptyd składający się z 84 reszt aminokwasowych, pozbawiony cysteiny, o masie cząsteczkowej około 9500 daltonów, powstający w przytarczycach z bioprekursora - proparathormonu (proPTH), który ma 6 dodatkowych aminokwasów na końcu NH2 . ProPTH jest syntetyzowany w głównych komórkach przytarczyc (w ich ziarnistym retikulum endoplazmatycznym) i w procesie rozszczepienia proteolitycznego w aparacie Golgiego przekształca się w parathormon. Jego aktywność biologiczna jest znacznie niższa od aktywności PTH. Najwyraźniej proPTH nie występuje we krwi zdrowych ludzi, ale w stanach patologicznych (z gruczolakiem przytarczyc) może wydzielać się do krwi razem z PTH. Niedawno odkryto prekursor proPTH, preproPTH, który zawiera dodatkowe 25 reszt aminokwasowych na końcu NH2. Tak więc preproPTH zawiera 115 reszt aminokwasowych, proPTH - 90, a PTH - 84.
Struktura parathormonu bydlęcego i wieprzowego została już w pełni ustalona. Ludzki parathormon został wyizolowany z gruczolaków przytarczyc, ale jego struktura została rozszyfrowana tylko częściowo. Istnieją różnice w strukturze parathormonu, ale zwierzęce i ludzkie parathormony wykazują krzyżową immunoreaktywność. Polipeptyd składający się z pierwszych 34 reszt aminokwasowych praktycznie zachowuje aktywność biologiczną naturalnego hormonu. Pozwala nam to założyć, że pozostałe prawie % cząsteczki na końcu karboksylowym nie jest bezpośrednio związane z głównymi efektami parathormonu. Fragment 1-29 parathormonu wykazuje również pewną aktywność biologiczną i immunologiczną. Biologicznie nieaktywny fragment 53-84 wykazuje również efekt immunologiczny, tj. te właściwości parathormonu wykazują co najmniej 2 sekcje jego cząsteczki.
Parathormon krążący we krwi jest heterogeniczny i różni się od natywnego hormonu wydzielanego przez przytarczyce. We krwi rozróżnia się co najmniej trzy różne rodzaje parathormonu: nienaruszony parathormon o masie cząsteczkowej 9500 daltonów; biologicznie nieaktywne substancje z karboksylowej części cząsteczki parathormonu o masie cząsteczkowej 7000-7500 daltonów; biologicznie aktywne substancje o masie cząsteczkowej około 4000 daltonów.
Jeszcze mniejsze fragmenty znaleziono we krwi żylnej, co wskazuje, że powstały one na obwodzie. Głównymi narządami, w których powstawały fragmenty parathormonu, były wątroba i nerki. Fragmentacja parathormonu w tych narządach była zwiększona w patologii wątroby i przewlekłej niewydolności nerek (CRF). W tych warunkach fragmenty parathormonu pozostawały we krwi znacznie dłużej niż u zdrowych osób. Wątroba wchłaniała głównie nienaruszony parathormon, ale nie usuwała z krwi ani karboksylo-końcowych, ani amino-końcowych fragmentów parathormonu. Nerki odgrywały wiodącą rolę w metabolizmie parathormonu. Stanowiły one prawie 60% klirensu metabolicznego karboksylo-końcowego immunoreaktywnego hormonu i 45% amino-końcowego fragmentu parathormonu. Głównym obszarem metabolizmu aktywnego amino-końcowego fragmentu parathormonu były kości.
Stwierdzono pulsujące wydzielanie parathormonu, najbardziej intensywne w nocy. Po 3-4 godzinach od rozpoczęcia snu nocnego jego zawartość we krwi jest 2,5-3 razy wyższa niż przeciętny poziom dzienny.
Główną funkcją parathormonu jest utrzymanie homeostazy wapnia. Jednocześnie wapń w surowicy (całkowity i zwłaszcza zjonizowany) jest głównym regulatorem wydzielania parathormonu (obniżenie poziomu wapnia stymuluje wydzielanie parathormonu, podczas gdy wzrost je hamuje), tj. regulacja odbywa się zgodnie z zasadą sprzężenia zwrotnego. W warunkach hipokalcemii wzrasta konwersja proPTH do parathormonu. Zawartość magnezu we krwi odgrywa również ważną rolę w uwalnianiu parathormonu (jego zwiększony poziom stymuluje, podczas gdy jego obniżony poziom hamuje wydzielanie parathormonu). Głównymi celami parathormonu są nerki i kości szkieletowe, ale znany jest wpływ parathormonu na wchłanianie wapnia w jelitach, tolerancję węglowodanów, poziom lipidów w surowicy, jego rolę w rozwoju impotencji, swędzenia skóry itp.
Aby scharakteryzować wpływ parathormonu na kości, konieczne jest przedstawienie krótkich informacji na temat budowy tkanki kostnej, cech jej fizjologicznej resorpcji i przebudowy.
Wiadomo, że większość wapnia w organizmie (do 99%) znajduje się w tkance kostnej. Ponieważ występuje on w kościach w postaci związków fosforowo-wapniowych, % całkowitej zawartości fosforu znajduje się również w kościach. Ich tkanka, pomimo pozornej statycznej natury, jest stale przebudowywana, aktywnie unaczyniona i ma wysokie właściwości mechaniczne. Kość jest dynamicznym „depotem” fosforu, magnezu i innych związków niezbędnych do utrzymania homeostazy w metabolizmie mineralnym. Jej struktura obejmuje gęste składniki mineralne, które są ściśle związane z macierzą organiczną, która składa się w 90-95% z kolagenu, niewielkich ilości mukopolisacharydów i białek niekolagenowych. Część mineralna kości składa się z hydroksyapatytu - jego wzór empiryczny to Ca10(PO4)6(OH)2 - i amorficznego fosforanu wapnia.
Kość tworzą osteoblasty pochodzące z niezróżnicowanych komórek mezenchymalnych. Są to komórki jednojądrowe biorące udział w syntezie składników organicznej macierzy kostnej. Znajdują się one w monowarstwie na powierzchni kości i pozostają w bliskim kontakcie z osteoidem. Osteoblasty odpowiadają za odkładanie osteoidu i jego późniejszą mineralizację. Produktem ich żywotnej aktywności jest fosfataza alkaliczna, której zawartość we krwi jest pośrednim wskaźnikiem ich aktywności. Otoczone zmineralizowanym osteoidem, niektóre osteoblasty przekształcają się w osteocyty - komórki jednojądrowe, których cytoplazma tworzy kanały połączone z kanałami sąsiednich osteocytów. Nie uczestniczą one w przebudowie kości, ale biorą udział w procesie niszczenia okołojądrowego, co jest ważne dla szybkiej regulacji poziomu wapnia w surowicy krwi. Resorpcję kości przeprowadzają osteoklasty - olbrzymie komórki wielojądrowe, najwyraźniej powstające w wyniku fuzji jednojądrowych makrofagów. Przypuszcza się również, że prekursorami osteoklastów mogą być hematopoetyczne komórki macierzyste szpiku kostnego. Są one ruchome, tworzą warstwę stykającą się z kością, zlokalizowaną w obszarach jej największej resorpcji. Ze względu na uwalnianie enzymów proteolitycznych i kwaśnej fosfatazy osteoklasty powodują degradację kolagenu, niszczenie hydroksyapatytu i usuwanie minerałów z macierzy. Nowo utworzona słabo zmineralizowana tkanka kostna (osteoid) jest odporna na resorpcję osteoklastyczną. Funkcje osteoblastów i osteoklastów są niezależne, ale skoordynowane ze sobą, co prowadzi do prawidłowej przebudowy szkieletu. Wzrost kości na długość zależy od kostnienia śródchrzęstnego, wzrost na szerokość i grubość - od kostnienia okostnowego. Badania kliniczne z 47 Ca wykazały, że do 18% całkowitej zawartości wapnia w szkielecie odnawia się każdego roku. Gdy kości ulegają uszkodzeniu (złamania, procesy infekcyjne), zmieniona kość ulega resorpcji i powstaje nowa kość.
Kompleksy komórkowe zaangażowane w lokalny proces resorpcji i formowania kości nazywane są podstawowymi wielokomórkowymi jednostkami przebudowy (BMU). Regulują one lokalne stężenie wapnia, fosforu i innych jonów, syntezę organicznych składników kości, w szczególności kolagenu, jej organizację i mineralizację.
Głównym działaniem parathormonu w kościach szkieletu jest nasilenie procesów resorpcji, oddziałując zarówno na składniki mineralne, jak i organiczne struktury kostnej. Parathormon wspomaga wzrost osteoklastów i ich aktywność, czemu towarzyszy wzmożone działanie osteolityczne i wzrost resorpcji kości. W tym przypadku kryształy hydroksyapatytu rozpuszczają się wraz z uwolnieniem wapnia i fosforu do krwi. Proces ten jest głównym mechanizmem zwiększania poziomu wapnia we krwi. Składa się z trzech komponentów: mobilizacji wapnia z kości okołostawowej (głębokie osteocyty); proliferacji komórek osteoprogeneracyjnych do osteoklastów; utrzymywania stałego poziomu wapnia we krwi poprzez regulację jego uwalniania z kości (powierzchowne osteocyty).
Parathormon początkowo zwiększa aktywność osteocytów i osteoklastów, nasilając osteolizę, powodując wzrost poziomu wapnia we krwi i zwiększone wydalanie wapnia i oksyproliny z moczem. Jest to pierwszy, jakościowy, szybki efekt parathormonu. Drugi efekt parathormonu na kości jest ilościowy. Jest on związany ze zwiększeniem puli osteoklastów. Przy aktywnej osteolizie następuje bodziec do zwiększonej proliferacji osteoblastów, aktywowane są zarówno resorpcja, jak i tworzenie kości z przewagą resorpcji. Przy nadmiarze parathormonu następuje ujemny bilans kostny. Towarzyszy temu nadmierne wydalanie oksyproliny - produktu degradacji kolagenu i kwasów sialowych wchodzących w skład struktury mukopolisacharydów. Parathormon aktywuje cykliczny adenozynomonofosforan (cAMP). Zwiększone wydalanie cAMP z moczem po podaniu parathormonu może służyć jako wskaźnik wrażliwości tkanek na ten hormon.
Najważniejszym działaniem parathormonu na nerki jest jego zdolność do zmniejszania wchłaniania zwrotnego fosforu, zwiększając fosfaturię. Mechanizm redukcji w różnych częściach nefronu jest różny: w części proksymalnej ten wpływ parathormonu wynika ze zwiększonej przepuszczalności i zachodzi przy udziale cAMP, natomiast w części dystalnej nie zależy od cAMP. Działanie fosfaturowe parathormonu zmienia się wraz z niedoborem witaminy D, kwasicą metaboliczną i zmniejszoną zawartością fosforu. Parathormon nieznacznie zwiększa całkowitą reabsorpcję zwrotną wapnia w kanalikach. Jednocześnie zmniejsza ją w częściach proksymalnych i zwiększa w częściach dystalnych. To ostatnie ma dominujące znaczenie - parathormon zmniejsza klirens wapnia. Parathormon zmniejsza reabsorpcję zwrotną sodu i jego wodorowęglanu w kanalikach, co może wyjaśniać rozwój kwasicy w nadczynności przytarczyc. Zwiększa wytwarzanie 1,25-dioksycholekalcyferolu 1,25(OH 2 )D 3 w nerkach – aktywnej formy witaminy D 3. Związek ten zwiększa wchłanianie zwrotne wapnia w jelicie cienkim poprzez stymulację aktywności specyficznego białka wiążącego wapń (CaBP) w jego ścianie.
Normalny poziom parathormonu wynosi średnio 0,15-0,6 ng/ml. Wahał się on w zależności od wieku i płci. Średnia zawartość parathormonu we krwi osób w wieku 20-29 lat wynosi (0,245±0,017) ng/ml, 80-89 lat - (0,545±0,048) ng/ml; poziom parathormonu u 70-letnich kobiet wynosi (0,728±0,051) ng/ml, u mężczyzn w tym samym wieku - (0,466±0,40) ng/ml. Zatem zawartość parathormonu wzrasta wraz z wiekiem, ale w większym stopniu u kobiet.
W celu różnicowania hiperkalcemii zazwyczaj stosuje się kilka różnych testów.
Przedstawiamy opracowaną przez nas klasyfikację kliniczno-patogenetyczną, opartą na klasyfikacji O.V. Nikołajewa i V.N. Tarkajewej (1974).
Klasyfikacja kliniczna i patogenetyczna chorób związanych z zaburzeniami wydzielania parathormonu i wrażliwością na niego
Pierwotna nadczynność przytarczyc
- Ze względu na patogenezę:
- gruczolak(i) nadczynny(e);
- hiperplazja OGD;
- nadczynny rak przytarczyc;
- zespół wieloogniskowej neoplazji wewnątrzwydzielniczej typu I z nadczynnością przytarczyc (zespół Wermera);
- zespół mnogiej neoplazji wewnątrzwydzielniczej typu II z nadczynnością przytarczyc (zespół Sipple'a).
- Według cech klinicznych:
- forma kostna:
- osteoporotyczny,
- włóknisto-torbielowate zapalenie kości,
- „Patoidalny”;
- postać trzewno-naczyniowa:
- z przewagą uszkodzeń nerek, przewodu pokarmowego, sfery neuropsychiatrycznej;
- forma mieszana.
- forma kostna:
- W dół rzeki:
- pikantny;
- chroniczny.
Wtórna nadczynność przytarczyc (wtórna nadczynność i przerost przytarczyc z długotrwałą hipokalcemią i hiperfosfatemią)
- Patologia nerek:
- przewlekła niewydolność nerek;
- tubulopatia (typu Albrighta-Fanconiego);
- krzywica nerkowa.
- Patologia jelit:
- zespół złego wchłaniania.
- Patologia kości:
- osteomalacja starcza;
- poporodowy;
- idiopatyczny;
- Choroba Pageta.
- Niedobór witaminy D:
- choroba nerek;
- wątroba;
- dziedziczne niedobory enzymów.
- Choroby złośliwe: szpiczak.
Nadczynność przytarczyc trzeciorzędowa
- Autonomicznie funkcjonujący gruczolak(i) przytarczyc, rozwijający się na tle długotrwałej wtórnej nadczynności przytarczyc.
Rzekoma nadczynność przytarczyc
- Produkcja parathormonu przez guzy pochodzenia nie-przytarczycowego.
Hormonalnie nieaktywne torbielowate i nowotworowe formacje przytarczyc
- Torbiel.
- Guzy hormonalnie nieaktywne lub rak.
Niedoczynność przytarczyc
- Wrodzony niedorozwój lub brak przytarczyc.
- Idiopatyczne, o podłożu autoimmunologicznym.
- Pooperacyjny, rozwijający się w związku z usunięciem przytarczyc.
- Pooperacyjne z powodu upośledzenia ukrwienia i unerwienia.
- Uszkodzenia popromienne, egzogenne i endogenne (radioterapia zewnętrzna, leczenie chorób tarczycy jodem radioaktywnym).
- Uszkodzenie przytarczyc spowodowane krwotokiem lub zawałem.
- Zmiany zakaźne.
Rzekoma niedoczynność przytarczyc
- Typ I - niewrażliwość narządów docelowych na parathormon, zależna od cyklazy adenylowej;
- Typ II – niewrażliwość narządów docelowych na parathormon, niezależna od cyklazy adenylowej, prawdopodobnie o podłożu autoimmunologicznym.
Rzekoma niedoczynność przytarczyc
Obecność objawów somatycznych rzekomej niedoczynności przytarczyc u zdrowych krewnych w rodzinach pacjentów z rzekomą niedoczynnością przytarczyc bez charakterystycznych zaburzeń biochemicznych i bez tężyczki.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

