Ekspert medyczny artykułu
Nowe publikacje
Poronienie nawykowe - przyczyny
Ostatnia recenzja: 04.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
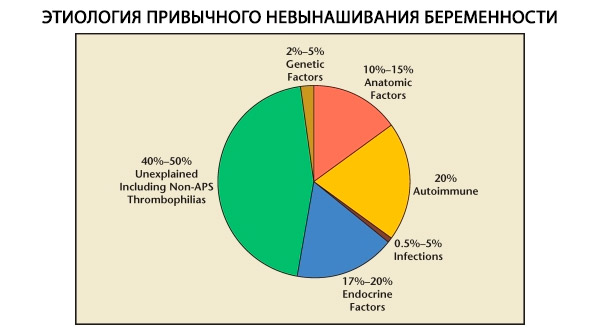
W strukturze nawykowych poronień wyróżnia się czynniki genetyczne, anatomiczne, endokrynologiczne, immunologiczne i zakaźne. Gdy wykluczy się wszystkie powyższe przyczyny, pozostaje grupa pacjentek, u których pochodzenie nawykowych poronień jest niejasne (poronienia idiopatyczne). Według C. Coulama i in. (1996) 80% idiopatycznych poronień ma podłoże w nierozpoznanych zaburzeniach immunologicznych.
Nie ma przekonujących dowodów na to, że endometrioza jest przyczyną nawracających poronień lub że leczenie farmakologiczne lub chirurgiczne endometriozy zmniejsza częstość występowania nawracających poronień.
Zgodnie z obecnymi koncepcjami, oprócz przyczyn genetycznych i częściowo zakaźnych prowadzących do powstania nieprawidłowego zarodka, realizacja szkodliwego wpływu innych czynników (anatomicznych, endokrynologicznych, immunologicznych) polega na stworzeniu niekorzystnego tła dla rozwoju kompletnego genetycznie zapłodnionego jaja, co prowadzi do wyczerpania rezerwowej pojemności kosmówki i ustania rozwoju (embriogenezy). Krytyczne okresy w pierwszym trymestrze ciąży uznaje się za 6-8 tygodni (śmierć zarodka) i 10-12 tygodni (wydalenie zapłodnionego jaja).
 [ 1 ]
[ 1 ]
Przyczyny genetyczne nawykowych poronień
Czynniki genetyczne odpowiadają za 3–6% przyczyn poronień nawykowych. Przy sporadycznym przerywaniu ciąży w pierwszym trymestrze około 50% poronień ma nieprawidłowości chromosomalne. Większość z nich (95%) to zmiany w liczbie chromosomów - monosomia (utrata jednego chromosomu), trisomia (obecność dodatkowego chromosomu), które są wynikiem błędów w mejozie, a także poliploidia (zwiększenie składu chromosomów o pełny zestaw haploidalny), która występuje, gdy komórka jajowa jest zapłodniona przez dwa lub więcej plemników. W poronieniach sporadycznych najczęściej spotykana jest trisomia - 60% wszystkich mutacji (najczęściej na chromosomie 16, a także 13, 18, 21, 22), na drugim miejscu pod względem częstości występowania jest zespół Shereshevsky'ego-Turnera (chromosom 45 X0) - 20%, pozostałe 15% przypada na poliploidię (szczególnie triploidię).
W przypadku zmiany liczby chromosomów w aborcji badanie kariotypu rodziców najczęściej nie ujawnia żadnej patologii, a prawdopodobieństwo choroby chromosomowej płodu w kolejnej ciąży wynosi 1%. Natomiast badając aborcje u par z poronieniami nawykowymi, zmiany strukturalne w chromosomach (wewnątrz- i międzychromosomowymi) obserwuje się w 3-6% przypadków. Badając kariotyp rodziców, zrównoważone rearanżacje chromosomowe stwierdza się w 7% przypadków. Najczęściej są to translokacje wzajemne, w których segment jednego chromosomu znajduje się w miejscu innego segmentu niehomologicznego chromosomu, a także mozaicyzm chromosomów płciowych, inwersja i wykrywanie chromosomów w postaci pierścienia. W przypadku występowania takich przegrupowań u jednego z małżonków, procesy parowania i rozdzielania chromosomów są utrudnione podczas mejozy, co skutkuje utratą (delecją) lub podwojeniem (duplikacją) odcinków chromosomowych w gametach. Powoduje to tzw. niezrównoważone przegrupowania chromosomowe, w których zarodek jest albo nieżywotny, albo jest nosicielem poważnej patologii chromosomowej. Prawdopodobieństwo urodzenia dziecka z niezrównoważonymi nieprawidłowościami chromosomowymi przy obecności zrównoważonych przegrupowań chromosomowych w kariotypie jednego z rodziców wynosi 1–15%. Różnice w danych są związane z charakterem przegrupowań, wielkością zaangażowanych segmentów, płcią nosiciela i historią rodzinną.
Diagnostyka
Anamneza
- Choroby dziedziczne u członków rodziny.
- Występowanie wad wrodzonych w rodzinie.
- Narodziny dzieci z upośledzeniem umysłowym.
- Występowanie niepłodności i/lub poronień o nieznanej przyczynie u pary małżeńskiej lub krewnych.
- Obecność niejasnych przypadków śmiertelności okołoporodowej.
Specjalne metody badawcze
- Badanie kariotypu rodziców jest szczególnie wskazane w przypadku par małżeńskich, u których noworodek ma wady rozwojowe i historię poronień, a także w przypadku nawykowych poronień we wczesnym okresie ciąży.
- Analiza cytogenetyczna poronień w przypadku urodzenia martwego dziecka lub śmiertelności noworodka.
Wskazania do konsultacji z innymi specjalistami
W przypadku wykrycia u rodziców zmian w kariotypie konieczna jest konsultacja genetyka, który oceni stopień ryzyka urodzenia dziecka z daną patologią lub, jeśli zajdzie taka potrzeba, podejmie decyzję o oddaniu komórki jajowej lub plemnika.
Dalsze postępowanie z pacjentem
Jeżeli u małżonków stwierdzono patologiczny kariotyp, choćby u jednego z rodziców, zaleca się przeprowadzenie w czasie ciąży diagnostyki prenatalnej - biopsji kosmówki lub amniopunkcji - ze względu na duże ryzyko wystąpienia zaburzeń rozwojowych u płodu.
Anatomiczne przyczyny poronień nawykowych
Do przyczyn anatomicznych poronień nawykowych zalicza się:
- wrodzone anomalie rozwoju macicy (całkowite podwojenie macicy; macica dwurożna, siodłowata, jednorożna; częściowa lub całkowita przegroda wewnątrzmaciczna);
- nabyte wady anatomiczne;
- zrosty wewnątrzmaciczne (zespół Ashermana);
- mięśniaki podśluzówkowe macicy;
- niewydolność cieśniowo-szyjna.
Częstość występowania anomalii anatomicznych u pacjentek z poronieniem nawykowym waha się od 10 do 16%. Częstość występowania wad macicy, które mogą skutkować poronieniem (ale nie bezpłodnością) w odniesieniu do wszystkich wad macicy przedstawia się następująco: macica dwurożna - 37%, macica siodłowata - 15%, przegroda wewnątrzmaciczna - 22%, całkowite podwojenie macicy - 11%, macica jednorożna - 4,4%.
Rozpoznanie poronienia nawykowego
Anamneza
W przypadku patologii anatomicznej macicy częściej obserwuje się późne zakończenia ciąży i porody przedwczesne, jednak przy implantacji w przegrodzie wewnątrzmacicznej lub w pobliżu węzła mięśniakowatego możliwe są także wcześniejsze zakończenia ciąży.
W przypadku niewydolności cieśniowo-szyjkowej objawem patognomonicznym jest samoistne zakończenie ciąży w II trymestrze lub przedwczesny poród, który następuje stosunkowo szybko i z niewielkim bólem.
W przypadku wad rozwojowych macicy należy zwrócić uwagę na wskazania anamnestyczne patologii układu moczowego (często towarzyszące wrodzonym anomaliom macicy) oraz charakter rozwoju czynności miesiączkowej (wskazania krwiaka macicy z czynnym szczątkowym rogiem macicy).
Specjalne metody badań
- Obecnie histerosalpingografię wykonuje się w celu postawienia diagnozy, która pozwala zbadać kształt jamy macicy, zidentyfikować obecność mięśniaków podśluzówkowych, zrostów, przegród i określić drożność jajowodów. W celu rozpoznania patologii macicy racjonalne jest wykonanie histerosalpingografii w okresie między miesiączką a owulacją, tj. w pierwszej fazie cyklu miesiączkowego po ustaniu krwawienia (7-9 dzień cyklu). W celu rozpoznania niewydolności cieśniowo-szyjkowej badanie wykonuje się w drugiej fazie cyklu miesiączkowego (18-20 dzień) w celu określenia stanu ujścia wewnętrznego szyjki macicy. Przed wykonaniem histerosalpingografii konieczne jest wykluczenie chorób zapalnych narządów miednicy mniejszej lub ich leczenie.
- Histeroskopia stała się w ostatnich latach powszechna i stała się złotym standardem w diagnostyce patologii wewnątrzmacicznej. Jednak ze względu na wyższy koszt w porównaniu z histerosalpingografią, metoda ta jest stosowana u kobiet ze wskazaniem patologii wewnątrzmacicznej na podstawie wstępnych danych ultrasonograficznych. Histeroskopia może być stosowana do badania jamy macicy, określenia charakteru patologii wewnątrzmacicznej, a jeśli dostępny jest niezbędny sprzęt (resektoskop), wykonania małoinwazyjnego leczenia chirurgicznego - usuwania zrostów, węzłów mięśniaków podśluzówkowych i polipów endometrium. Podczas usuwania przegrody wewnątrzmacicznej preferowana jest histeroresektoskopia pod kontrolą laparoskopową, co zapobiega możliwości perforacji ściany macicy.
- Badanie USG wykonuje się w pierwszej fazie cyklu miesiączkowego, co pozwala na wstępne rozpoznanie mięśniaków podśluzówkowych macicy, zrostów wewnątrzmacicznych, a w drugiej fazie cyklu – na identyfikację przegrody wewnątrzmacicznej i macicy dwurożnej. Metoda ta ma szczególne znaczenie we wczesnych stadiach ciąży, kiedy jej czułość w diagnozowaniu tych stanów wynosi 100%, a swoistość 80%. Poza ciążą rozpoznanie wymaga dodatkowego potwierdzenia innymi metodami.
- Autorzy zagraniczni wskazują na przewagę sonohisterografii (badania USG z wykorzystaniem czujnika przezpochwowego z wstępnym wprowadzeniem 0,9% roztworu chlorku sodu do jamy macicy) nad histerosalpingografią, gdyż umożliwia ona różnicową diagnostykę przegrody wewnątrzmacicznej i macicy dwurożnej. Za pomocą sonohisterografii można nie tylko zbadać kształt jamy macicy, ale także określić konfigurację dna trzonu macicy. W naszym kraju metoda ta nie stała się powszechna.
- W niektórych skomplikowanych przypadkach w celu potwierdzenia rozpoznania stosuje się MRI narządów miednicy. Metoda ta pozwala uzyskać cenne informacje w przypadku anomalii rozwojowych macicy, którym towarzyszy nietypowe rozmieszczenie narządów w miednicy. MRI jest ważne w przypadku szczątkowego rogu macicy, aby zdecydować, czy wskazane jest jego usunięcie. Konieczność usunięcia szczątkowego rogu macicy występuje w przypadku jego połączenia z jajowodem i jajnikiem, aby zapobiec powstaniu i rozwojowi w nim zapłodnionego jaja. Zakończenie ciąży w przypadku anomalii anatomicznych macicy może być związane z nieudaną implantacją zapłodnionego jaja (na przegrodzie wewnątrzmacicznej, w pobliżu węzła mięśniakowego podśluzówkowego), niedostatecznie rozwiniętym unaczynieniem i recepcją endometrium, ścisłymi relacjami przestrzennymi w jamie macicy (na przykład w przypadku deformacji jamy przez węzeł mięśniaka), często towarzyszącymi ICI i zaburzeniami hormonalnymi.
Leczenie poronień nawykowych
Leczenie chirurgiczne
W przypadku przegrody wewnątrzmacicznej, mięśniaków podśluzówkowych i zrostów najskuteczniejszym leczeniem chirurgicznym jest histeroresektoskopia. Częstość kolejnych poronień w tej grupie kobiet po leczeniu wynosi 10% w porównaniu do 90% przed operacją. Porównując wyniki metroplastyki wykonanej laparotomią i histeroresektoskopią przezszyjkową, P. Heinonen (1997) uzyskał wyniki wskazujące na mniejszy uraz i większą skuteczność histeroresektoskopii; odsetek ciąż zakończonych urodzeniem żywych dzieci wynosił odpowiednio 68 i 86%.
Chirurgiczne usunięcie przegrody wewnątrzmacicznej, zrostów i mięśniaków podśluzówkowych eliminuje poronienie w 70–80% przypadków. Jest to jednak nieskuteczne u kobiet z wadami macicy, które rodziły naturalnie, a następnie miały nawracające poronienia. Jest prawdopodobne, że w takich przypadkach czynnik anatomiczny nie jest główną przyczyną i konieczne jest poszukiwanie innych przyczyn poronienia.
Udowodniono, że metroplastyka brzuszna wiąże się ze znacznym ryzykiem niepłodności pooperacyjnej i nie poprawia rokowania co do kolejnej ciąży. Dlatego lepiej jest dać pierwszeństwo histeroskopii i operacjom laparoskopowym.
Leczenie farmakologiczne
Nie udowodniono skuteczności wprowadzenia wkładki wewnątrzmacicznej, dużych dawek leków estrogenowych, wprowadzenia cewnika Foleya do jamy macicy po zabiegach usuwania zrostów, przegrody wewnątrzmacicznej. Zaleca się planowanie ciąży nie wcześniej niż 3 miesiące po operacji. Aby poprawić wzrost endometrium, cykliczną terapię hormonalną prowadzi się przez 3 cykle miesiączkowe [14]. Przez 3 miesiące w pierwszych 14 dniach cyklu wskazane jest przyjmowanie leku zawierającego 2 mg 17-beta-estradiolu, w kolejnych 14 dniach - 2 mg 17-beta-estradiolu i 20 mg dydrogesteronu (10 mg dydrogesteronu jako część leku złożonego plus 10 mg dydrogesteronu w oddzielnej postaci tabletki).
Dalsze postępowanie z pacjentem
Cechy przebiegu ciąży przy macicy dwurożnej lub zdwojonej (gdy występują 2 jamy macicy):
- we wczesnym stadium ciąży krwawienie często występuje z „pustego” rogu lub jamy macicy na skutek wyraźnej reakcji doczesnowej; taktyka w tym przypadku powinna być zachowawcza i polegać na stosowaniu środków rozkurczowych i hemostatycznych;
- groźba przerwania ciąży na różnym etapie;
- rozwój niewydolności cieśniowo-szyjnej;
- zahamowanie wzrostu wewnątrzmacicznego spowodowane niewydolnością łożyska.
We wczesnym okresie ciąży, w przypadku wystąpienia krwawienia, wskazany jest odpoczynek w łóżku lub półleżeniu, a także podawanie leków hemostatycznych, rozkurczowych i uspokajających oraz terapia gestagenami (dydrogesteron w dawce dobowej 20–40 mg) do 16–18 tygodnia ciąży.
Przyczyny endokrynologiczne nawykowych poronień
Według różnych autorów przyczyny poronień o podłożu endokrynologicznym odpowiadają za 8–20%. Do najważniejszych z nich zalicza się niedobór fazy lutealnej (LPD), nadmierne wydzielanie LH, dysfunkcję tarczycy i cukrzycę.
Ciężka choroba tarczycy lub cukrzyca mogą prowadzić do powtarzających się poronień. Jednak w przypadku wyrównanej cukrzycy ryzyko nawykowych poronień nie różni się od ryzyka w populacji ogólnej.
Jednocześnie wysoka częstość występowania niedoczynności tarczycy w populacji wymaga badań przesiewowych z pomiarem poziomu TSH. U pacjentek z poronieniem nawykowym niewydolność fazy lutealnej obserwuje się w 20–60% przypadków, a ultrasonograficzne objawy policystycznych jajników – w 44–56%. Zgodnie z literaturą, wpływ poszczególnych zaburzeń hormonalnych na powstawanie zespołu objawów poronienia nawykowego pozostaje kontrowersyjny. Badania M. Ogasawara i wsp. (1997) nie wykazały wiarygodnych różnic w częstości przerywania ciąży z i bez LPI u pacjentek z dwoma lub więcej wcześniejszymi poronieniami w wywiadzie, wykluczając przyczyny autoimmunologiczne, anatomiczne i zakaźne.
Niewydolność ciałka żółtego może być wynikiem szeregu niekorzystnych czynników:
- zaburzenia wydzielania FSH i LH w pierwszej fazie cyklu miesiączkowego;
- wczesny lub odwrotnie, zbyt późny szczyt uwalniania LH;
- hipoestrogenizm jako konsekwencja niewystarczającej folikulogenezy. Wszystkie te stany nie podlegają korekcji za pomocą terapii zastępczej lekami gestagenowymi w okresie poowulacyjnym. Badania prospektywne przeprowadzone przez L. Regana i in. wykazały istotny wzrost częstości poronień u pacjentek z hipersekrecją LH w 8. dniu cyklu miesiączkowego w porównaniu do kobiet z prawidłowym poziomem LH we krwi (odpowiednio 65% i 12% poronień). Niszczący wpływ przedwczesnego wyrzutu LH wiąże się z przedwczesnym wznowieniem drugiego podziału mejotycznego i owulacją niedojrzałej komórki jajowej, a także z indukcją produkcji androgenów przez komórki tekalne wraz z upośledzonym odbiorem endometrium pod wpływem niedoboru gestagenu. Jednak wstępne obniżenie przedowulacyjnych poziomów LH za pomocą agonistów hormonu uwalniającego gonadotropinę bez dodatkowych działań mających na celu przedłużenie kolejnej ciąży nie zapewnia oczekiwanego zmniejszenia częstości poronień.
Złotym standardem w diagnostyce NLF jest badanie histologiczne materiału pobranego podczas biopsji endometrium w drugiej fazie cyklu, w ciągu 2 cykli miesiączkowych.
Rozpoznanie innych przyczyn zaburzeń owulacji, takich jak hiperprolaktynemia, niedoczynność tarczycy, czynnościowy nadmiar androgenów (jajnikowych lub nadnerczowych) powinno wiązać się z zaleceniem odpowiedniego leczenia.
Diagnostyka
Wywiad i badanie fizykalne
- Historia. Czynniki, które należy wziąć pod uwagę: późna menarche, nieregularny cykl menstruacyjny (oligomenorrhea, amenorrhea, nagły przyrost masy ciała, utrata masy ciała, niepłodność, nawykowe wczesne poronienia).
- Badanie: typ budowy ciała, wzrost, masa ciała, hirsutyzm, nasilenie drugorzędnych cech płciowych, obecność rozstępów, badanie gruczołów piersiowych pod kątem mlekotoku.
- Badania diagnostyczne czynnościowe: pomiar temperatury odbytu w ciągu 3 cykli menstruacyjnych.
Specjalne metody badawcze
- Badanie hormonalne:
- w I fazie cyklu miesiączkowego (7–8 dzień) – oznaczenie zawartości FSH, LH, prolaktyny, TSH, testosteronu, 17-hydroksyprogesteronu (17-OP), DHEAS;
- w II fazie cyklu miesiączkowego (21–22 dzień) – oznaczenie zawartości progesteronu (wskaźniki normatywne poziomu progesteronu są bardzo zmienne, metoda nie może być stosowana bez uwzględnienia innych czynników).
- Ultradźwięk:
- w I fazie cyklu miesiączkowego (5–7 dzień) – diagnostyka patologii endometrium, zespół policystycznych jajników;
- w II fazie cyklu miesiączkowego (20–21 dzień) – pomiar grubości endometrium (norma 10–11 mm, koreluje z zawartością progesteronu).
- Biopsję endometrium w celu weryfikacji NLF wykonuje się 2 dni przed spodziewaną miesiączką (26. dnia cyklu 28-dniowego). Tę metodę stosuje się w przypadkach, gdy diagnoza jest niejasna. Aby zbadać zmiany w endometrium w okresie tzw. „okna implantacyjnego”, biopsję wykonuje się 6. dnia po owulacji.
Leczenie
W przypadku diagnostyki NLF (według wykresów temperatury odbytu, czas trwania II fazy jest krótszy niż 11 dni, obserwuje się stopniowy wzrost temperatury, niedostateczną przemianę wydzielniczą endometrium zgodnie z danymi z biopsji endometrium, niskie stężenie progesteronu w surowicy krwi) konieczne jest ustalenie przyczyny takich zaburzeń.
Jeśli NLF towarzyszy hiperprolaktynemia, wykonuje się MRI mózgu. Alternatywną metodą jest prześwietlenie czaszki (okolica siodła tureckiego).
Pierwszym etapem hiperprolaktynemii jest wykluczenie gruczolaka przysadki, co wymaga leczenia operacyjnego. W przypadku braku istotnych zmian hiperprolaktynemię uważa się za funkcjonalną, a leczenie bromokryptyną przepisuje się w celu normalizacji poziomu prolaktyny. Początkowa dawka bromokryptyny wynosi 1,25 mg/dobę przez 2 tygodnie, po monitorowaniu poziomu prolaktyny, jeśli wskaźniki nie ulegną normalizacji, dawkę zwiększa się do 2,5 mg/dobę. Przy znacznym wzroście poziomu prolaktyny początkowa dawka wynosi 2,5 mg/dobę. W przypadku zajścia w ciążę należy przerwać stosowanie bromokryptyny.
W przypadku wykrycia niedoczynności tarczycy charakter patologii tarczycy ustala się wspólnie z endokrynologiem. W każdym przypadku wskazana jest codzienna terapia lewotyroksyną sodową, dawka dobierana jest indywidualnie do momentu normalizacji poziomu TSH. W przypadku zajścia w ciążę należy kontynuować leczenie lewotyroksyną sodową. Kwestię celowości zwiększenia dawki w pierwszym trymestrze ciąży rozstrzyga się wspólnie z endokrynologiem po otrzymaniu wyników badania hormonalnego (poziom TSH, wolna tyroksyna).
Korekta NLF jest przeprowadzana na jeden z dwóch sposobów. Pierwszy sposób to stymulacja owulacji, drugi sposób to terapia zastępcza preparatami progesteronu.
Pierwszą opcją leczenia jest stymulacja owulacji cytrynianem klomifenu. Ta metoda leczenia opiera się na fakcie, że większość zaburzeń fazy lutealnej występuje w fazie folikularnej cyklu. Ciągle obniżone poziomy progesteronu w 2. fazie są konsekwencją upośledzonej folikulogenezy w 1. fazie cyklu. Zaburzenie to można skuteczniej korygować niskimi dawkami cytrynianu klomifenu we wczesnej fazie folikularnej niż przepisując progesteron w 2. fazie cyklu.
W 1 cyklu dawka cytrynianu klomifenu wynosi 50 mg/dobę od 5 do 9 dnia cyklu miesiączkowego. Skuteczność monitorowana jest za pomocą wykresów temperatury odbytu, pomiarów poziomu progesteronu w 2 fazie cyklu lub dynamicznego USG. Jeśli w 2 cyklu stymulacji owulacji nie ma wystarczającego efektu, dawkę cytrynianu klomifenu należy zwiększyć do 100 mg/dobę od 5 do 9 dnia cyklu. Maksymalna możliwa dawka w 3 cyklu stymulacji owulacji wynosi 150 mg/dobę. Takie zwiększenie dawki jest możliwe tylko wtedy, gdy lek jest dobrze tolerowany (brak silnego bólu w dolnej części brzucha i dolnej części pleców oraz brak innych objawów hiperstymulacji jajników).
Druga opcja leczenia: terapia zastępcza preparatami progesteronu, które promują pełną przemianę wydzielniczą endometrium, co daje niezbędny efekt u pacjentek z nawykowym poronieniem z zachowaną owulacją. Ponadto w ostatnich latach ustalono, że podawanie preparatów progesteronu ma nie tylko działanie hormonalne, ale także immunomodulacyjne, tłumiąc reakcje odrzucenia ze strony komórek immunokompetentnych w endometrium. W szczególności podobny efekt opisano dla dihydrogesteronu w dawce 20 mg/dobę. W celu terapii zastępczej stosuje się dydrogesteron w dawce 20 mg/dobę doustnie lub mikronizowany progesteron dopochwowo w dawce 200 mg/dobę. Leczenie przeprowadza się 2. dnia po owulacji (dzień po wzroście temperatury odbytu) i trwa 10 dni. W przypadku zajścia w ciążę należy kontynuować leczenie preparatami progesteronu.
Współczesne badania nie potwierdziły skuteczności gonadotropiny kosmówkowej w leczeniu nawracających poronień.
W hiperandrogenizmie (geneza jajnikowa lub nadnerczowa) u pacjentek z nawykowym poronieniem wskazane jest leczenie farmakologiczne ze względu na wpływ androgenów na kompletność owulacji i stan endometrium. W przypadku zaburzenia biosyntezy androgenów nadnerczowych możliwe jest ich wirylizujące działanie na płód żeński, dlatego w interesie płodu prowadzi się terapię sterydową.
Hiperandrogenizm pochodzenia jajnikowego (jajniki policystyczne)
Wywiad, badanie fizykalne i wyniki badań specjalistycznych
- Historia: późna menarche, zaburzenia cyklu menstruacyjnego, takie jak oligomenorrhea (zwykle pierwotne, rzadziej wtórne). Ciąża jest rzadka, zwykle samoistnie przerywana w pierwszym trymestrze, z długimi okresami niepłodności między ciążami.
- Badanie: hirsutyzm, trądzik, rozstępy, wysoki wskaźnik masy ciała (opcjonalnie).
- Wykresy temperatury odbytu: cykle bezowulacyjne występują naprzemiennie z cyklami z owulacją i NLF.
- Badanie hormonalne: wysoki poziom testosteronu, może być podwyższony poziom FSH i LH, stosunek LH/FSH większy niż 3. USG: policystyczne jajniki.
Leczenie
Leczenie bez leków
Odchudzanie - dietoterapia, aktywność fizyczna.
Leczenie farmakologiczne
- Orlistat w dawce 120 mg z każdym głównym posiłkiem. Czas trwania kuracji ustala się biorąc pod uwagę efekt i tolerancję.
- Wstępna redukcja testosteronu za pomocą preparatów zawierających octan cyproteronu (2 mg) i EE (35 µg) przez 3 cykle miesiączkowe.
- Odstawienie antykoncepcji, hormonalne wsparcie drugiej fazy cyklu (terapia gestagenowa) - dydrogesteron w dawce 20 mg/dobę od 16 do 25 dnia cyklu miesiączkowego. Jeśli nie ma samoistnej owulacji, należy przejść do następnego etapu.
- Stymulacja owulacji cytrynianem klomifenu w dawce początkowej 50 mg/dobę od 5. do 9. dnia cyklu miesiączkowego z równoczesną terapią gestagenami (dydrogesteron w dawce 20 mg/dobę od 16. do 25. dnia cyklu) i deksametazonem (0,5 mg).
- W przypadku braku ciąży dawkę cytrynianu klomifenu zwiększa się do 100–150 mg/dobę, podając gestageny w drugiej fazie cyklu i deksametazon (0,5 mg). Ustalono, że chociaż deksametazon obniża jedynie poziom androgenów nadnerczowych, owulacja i poczęcie występują znacznie częściej przy leczeniu cytrynianem klomifenu i deksametazonem niż przy stosowaniu wyłącznie cytrynianu klomifenu [12].
- Wykonuje się trzy cykle stymulacji owulacji, po których zaleca się przerwę trzech cykli menstruacyjnych ze wsparciem gestagenem i decyzję o leczeniu operacyjnym z dostępu laparoskopowego (klinowa resekcja jajników, laserowa waporyzacja).
Dalsze postępowanie z pacjentem
Prowadzenie ciąży powinno być wspomagane gestagenem do 16. tygodnia ciąży (dydrogesteron w dawce 20 mg/dobę lub mikronizowany progesteron w dawce 200 mg/dobę), deksametazon przepisywany jest tylko w pierwszym trymestrze ciąży. Monitorowanie jest obowiązkowe w celu terminowego rozpoznania niewydolności cieśniowo-szyjkowej i w razie potrzeby jej korekcji chirurgicznej.
Hiperandrogenizm nadnerczy (zespół adrenogenitalny okresu dojrzewania i popokwitaniowy)
Zespół adrenogenitalny (AGS) to choroba dziedziczna związana z zaburzeniem syntezy hormonów kory nadnerczy z powodu uszkodzenia genów odpowiedzialnych za syntezę szeregu układów enzymatycznych. Choroba jest dziedziczona w sposób autosomalny recesywny z przekazywaniem zmutowanych genów od obojga rodziców, którzy są zdrowymi nosicielami.
W 90% przypadków zespół adrenogenitalny jest spowodowany mutacjami w genie CYP21B, prowadzącymi do zaburzenia syntezy 21-hydroksylazy.
Wywiad, badanie fizykalne i wyniki badań specjalistycznych
- Wywiad: późna pierwsza miesiączka, nieznacznie przedłużony cykl menstruacyjny, możliwe skąpe miesiączki, poronienia samoistne w pierwszym trymestrze, możliwa bezpłodność.
- Badanie: trądzik, hirsutyzm, budowa ciała androidalna (szerokie ramiona, wąska miednica), przerost łechtaczki.
- Wykresy temperatury odbytu: cykle bezowulacyjne występują naprzemiennie z cyklami z owulacją i NLF.
- Test hormonalny: wysoki poziom 17-OP, DHEAS.
- USG: jajniki bez zmian.
Objawem patognomonicznym poza ciążą jest wzrost stężenia 17-OP w osoczu krwi.
Obecnie do diagnozy utajonej, nieklasycznej postaci hiperandrogenizmu nadnerczowego stosuje się test z ACTH. Do tego testu stosuje się Synacthen - syntetyczny polipeptyd, który ma właściwości endogennego ACTH, tzn. stymuluje początkowe fazy syntezy hormonów steroidowych z cholesterolu w nadnerczach.
Test z synacthenem (analog ACTH): 1 ml (0,5 mg) synacthenu wstrzykuje się podskórnie w ramię, początkową zawartość 17-OP i kortyzolu określa się najpierw w porannej 9-godzinnej próbce osocza krwi. Kontrolną próbkę krwi pobiera się 9 godzin po wstrzyknięciu, aby określić poziom 17-OP i kortyzolu. Następnie oblicza się wskaźnik oznaczalności (D) za pomocą wzoru:
D = 0,052 × 17-OP + 0,005 × Kortyzol/17-OP - 0,018 × Kortyzol/17-OP
Jeśli współczynnik D jest mniejszy lub równy 0,069, oznacza to brak hiperandrogenizmu nadnerczowego. Jeśli współczynnik D jest większy niż 0,069, należy uznać, że hiperandrogenizm jest spowodowany dysfunkcją nadnerczy.
Leczenie farmakologiczne
Podstawą leczenia hiperandrogenizmu spowodowanego niedoborem 21-hydroksylazy są glikokortykoidy, które służą do hamowania nadmiernego wydzielania androgenów.
Dalsze postępowanie z pacjentem
Ze względu na wirylizujący wpływ androgenów matczynych na płód, przy ustalonym rozpoznaniu hiperandrogenizmu nadnerczowego, leczenie deksametazonem w dawce początkowej 0,25 mg jest przepisywane przed ciążą i kontynuowane w indywidualnie dobranej dawce (od 0,5 do 1 mg) przez cały okres ciąży. U kobiety z nawykowym poronieniem cierpiącej na hiperandrogenizm nadnerczowy nie jest wskazane przerwanie leczenia, ponieważ częstość poronień przy braku leczenia sięga 14%, przy kontynuacji - 9%.
Biorąc pod uwagę fakt, że pacjentki z zespołem adrenogenitalnym mogą przekazać ten gen płodowi, konieczne jest przeprowadzenie diagnostyki prenatalnej: w 17-18 tygodniu ciąży zleca się badanie krwi w celu określenia zawartości 17-OP u matki. Jeśli poziom hormonu we krwi jest podwyższony, oznacza się jego stężenie w płynie owodniowym. Jeśli zawartość 17-OP w płynie owodniowym jest podwyższona, diagnozuje się zespół adrenogenitalny u płodu. Niestety, nie można określić stopnia zaawansowania zespołu adrenogenitalnego (łagodna lub ciężka postać z utratą soli) na podstawie poziomu 17-OP w płynie owodniowym. Kwestię utrzymania ciąży w tej sytuacji rozstrzygają rodzice.
Jeśli ojciec dziecka jest nosicielem genu zespołu adrenogenitalnego i w rodzinie zdarzały się przypadki dzieci urodzonych z tym zespołem, wówczas pacjent, nawet bez hiperandrogenizmu nadnerczowego, otrzymuje deksametazon w interesie płodu (aby zapobiec wirylizacji płodu żeńskiego) w dawce 20 mcg/kg masy ciała, maksymalnie 1,5 mg/dobę w 2-3 dawkach po posiłkach. W 17-18 tygodniu, po ustaleniu płci płodu i ekspresji genu zespołu adrenogenitalnego (na podstawie wyników amniopunkcji), leczenie kontynuuje się do końca ciąży, jeśli płód jest dziewczynką z zespołem adrenogenitalnym. Jeśli płód jest chłopcem lub dziewczynką, która nie jest nosicielem genu zespołu adrenogenitalnego, można przerwać podawanie deksametazonu.
Jeśli kobieta z nawykowym poronieniem cierpi na hiperandrogenizm nadnerczowy, leczenie deksametazonem jest prowadzone przez całą ciążę i jest przerywane dopiero po porodzie. W 3. dniu po porodzie dawkę deksametazonu stopniowo zmniejsza się (o 0,125 mg co 3 dni) aż do całkowitego odstawienia w okresie poporodowym.
Hiperandrogenizm o mieszanej genezie (jajnikowo-nadnerczowej)
Wywiad, badanie fizykalne i wyniki badań specjalistycznych
- Historia: późna menarche, zaburzenia cyklu menstruacyjnego, takie jak oligomenorrhea (zwykle pierwotna, rzadziej wtórna), brak miesiączki, możliwe urazy, wstrząsy mózgu. Ciąża jest rzadka, zwykle samoistnie przerywana w pierwszym trymestrze, długie okresy niepłodności między ciążami.
- Badanie fizykalne: hirsutyzm, trądzik, rozstępy, akantoza ciemna, wysoki wskaźnik masy ciała, nadciśnienie.
- Wykresy temperatury odbytu: cykle bezowulacyjne występują naprzemiennie z cyklami z owulacją i NLF.
- Badanie hormonalne: wysoki poziom testosteronu, mogą być podwyższone poziomy FSH i LH, stosunek LH/FSH powyżej 3, wysokie poziomy DHEAS, 17-OP, może być obecna hiperprolaktynemia.
- USG: jajniki policystyczne.
- Elektroencefalografia: zmiany w aktywności bioelektrycznej mózgu.
- Hiperinsulinemia, zaburzenia metabolizmu lipidów (wysokie stężenie cholesterolu, lipoprotein o małej gęstości i lipoprotein o bardzo małej gęstości), zmniejszona tolerancja glukozy lub podwyższony poziom glukozy we krwi.
Leczenie
Leczenie bez leków
Utrata masy ciała (dieta niskokaloryczna, aktywność fizyczna).
Leczenie farmakologiczne
Pierwszy etap - w przypadku insulinooporności zaleca się przepisywanie metforminy w dawce dobowej 1000-1500 mg w celu zwiększenia wrażliwości na insulinę.
Drugi etap - przy ciężkich zaburzeniach cyklu miesiączkowego i wysokim poziomie testosteronu zaleca się przepisywanie leków o działaniu antyandrogennym zawierających octan cyproteronu (2 mg) i etynyloestradiol (35 µg) przez okres 3 miesięcy.
Trzeci etap to stymulacja owulacji, a następnie wspomaganie się gestagenem (schemat opisany powyżej) i przyjmowanie deksametazonu w dawce dobowej 0,25–0,5 mg.
W przypadku hiperprolaktynemii i niedoczynności tarczycy należy przeprowadzić odpowiednią korektę lekową w cyklach stymulacji owulacji. Jeśli dojdzie do ciąży, bromokryptynę należy odstawić, a lewotyroksynę kontynuować.
Jeśli stymulacja owulacji okaże się nieskuteczna, należy rozważyć zastosowanie bezpośrednich leków wywołujących owulację, zasadność leczenia operacyjnego policystycznych jajników lub zapłodnienie in vitro.
Dalsze postępowanie z pacjentem
U pacjentek z zespołem metabolicznym ciąża często jest powikłana nadciśnieniem tętniczym, nefropatią, hiperkoagulacją, w związku z czym konieczne jest monitorowanie ciśnienia krwi, hemostazogramów od wczesnych stadiów ciąży i korygowanie powstających zaburzeń (w razie potrzeby) lekami przeciwnadciśnieniowymi, przeciwpłytkowymi i przeciwzakrzepowymi. Leki gestagenowe przepisuje się do 16 tygodnia ciąży - didrogesteron w dawce 20 mg/dobę lub mikronizowany progesteron w dawce 200 mg/dobę w 2 dawkach.
Wszystkie kobiety z hiperandrogenizmem stanowią grupę ryzyka rozwoju niewydolności cieśniowo-szyjkowej. Monitorowanie stanu szyjki macicy powinno być prowadzone od 16. tygodnia ciąży, w razie potrzeby - korekcja chirurgiczna niewydolności cieśniowo-szyjkowej.
Immunologiczne przyczyny nawykowych poronień
Obecnie wiadomo, że około 80% wszystkich wcześniej niewyjaśnionych przypadków powtarzających się poronień (po wykluczeniu przyczyn genetycznych, anatomicznych, hormonalnych) wiąże się z zaburzeniami odporności. Wyróżnia się zaburzenia autoimmunologiczne i alloimmunologiczne, prowadzące do nawykowych poronień.
W procesach autoimmunologicznych tkanki własne układu odpornościowego stają się obiektem agresji, tzn. odpowiedź immunologiczna jest skierowana przeciwko własnym antygenom. W tej sytuacji płód cierpi wtórnie w wyniku uszkodzenia tkanek matki.
W przypadku chorób alloimmunologicznych odpowiedź immunologiczna kobiety skierowana jest przeciwko antygenom zarodka/płodu otrzymanym od ojca, które mogą być potencjalnie obce dla organizmu matki.
Do najczęściej występujących chorób autoimmunologicznych u pacjentek z poronieniami nawykowymi zalicza się obecność w surowicy przeciwciał antyfosfolipidowych, przeciwtarczycowych i przeciwjądrowych. W ten sposób ustalono, że 31% kobiet z poronieniami nawykowymi poza ciążą ma autoprzeciwciała przeciwko tyreoglobulinie i peroksydazie tarczycowej (przeciwciała przeciwko mikrosomom tarczycy [peroksydazie tarczycowej]); w takich przypadkach ryzyko samoistnego poronienia w pierwszym trymestrze ciąży wzrasta do 20%. W przypadku poronień nawykowych obecność przeciwciał przeciwjądrowych i przeciwtarczycowych wskazuje na konieczność dalszych badań w celu zidentyfikowania procesu autoimmunologicznego i potwierdzenia rozpoznania.
Zespół antyfosfolipidowy (APS) pozostaje powszechnie uznawaną chorobą autoimmunologiczną prowadzącą do śmierci zarodka/płodu.
Zaburzenia alloimmunologiczne
Obecnie do procesów alloimmunologicznych prowadzących do odrzucenia płodu zalicza się obecność zwiększonej (ponad 3) liczby wspólnych antygenów głównego układu zgodności tkankowej u małżonków (często obserwowanej w małżeństwach między krewnymi); niskie poziomy czynników blokujących w surowicy matki; zwiększone poziomy komórek NK (komórek NK CD56, CD16) w endometrium i krwi obwodowej matki zarówno poza ciążą, jak i w czasie ciąży; wysokie poziomy stężenia szeregu cytokin w endometrium i surowicy krwi, w szczególności γ-interferonu, czynnika martwicy nowotworu a, interleukin-1 i 2.
Obecnie badane są czynniki alloimmunologiczne prowadzące do wczesnych poronień i sposoby korygowania powyższych stanów. Nie ma konsensusu co do metod terapii. Według niektórych badaczy, aktywna immunizacja limfocytami dawcy nie daje znaczącego efektu, podczas gdy inni autorzy opisują znaczący pozytywny efekt takiej immunizacji i leczenia immunoglobulinami.
Obecnie jednym z czynników immunomodulujących we wczesnej ciąży jest progesteron. W szczególności badania udowodniły rolę dydrogesteronu w dawce dziennej 20 mg u kobiet z nawykowymi poronieniami w pierwszym trymestrze ciąży ze zwiększonym poziomem komórek CD56 w endometrium.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Trombofilie uwarunkowane genetycznie
Poniższe formy trombofilii uwarunkowanej genetycznie uważa się za schorzenia trombofilowe występujące w czasie ciąży, prowadzące do nawykowych poronień.
- Niedobór antytrombiny III.
- Mutacja czynnika V (mutacja Leiden).
- Niedobór białka C.
- Niedobór białka S.
- Mutacja genu protrombiny G20210A.
- Hiperhomocysteinemia.
Badanie mające na celu ustalenie rzadkich przyczyn trombofilii jest konieczne w przypadkach, gdy wystąpiły:
- wywiad rodzinny - występowanie zakrzepicy przed 40 rokiem życia u krewnych;
- pewne epizody zakrzepicy żylnej i/lub tętniczej przed 40 rokiem życia;
- nawracające zakrzepy u chorego i jego najbliższych krewnych;
- powikłania zakrzepowo-zatorowe w czasie ciąży i po porodzie przy stosowaniu antykoncepcji hormonalnej;
- powtarzające się poronienia, urodzenia martwych dzieci, zahamowanie wzrostu wewnątrzmacicznego, odklejenie się łożyska;
- wczesna stan przedrzucawkowy, zespół HELLP.
Przyczyny zakaźne nawykowych poronień
Rola czynnika zakaźnego jako przyczyny nawykowych poronień jest obecnie szeroko dyskutowana. Wiadomo, że pierwotne zakażenie we wczesnych stadiach ciąży może powodować uszkodzenia zarodka, które są niezgodne z życiem, co prowadzi do sporadycznych samoistnych poronień. Jednak prawdopodobieństwo reaktywacji zakażenia w tym samym czasie, co wynik powtarzających się poronień, jest znikome. Ponadto, nie znaleziono obecnie mikroorganizmów, które wywołują nawykowe poronienia. Badania przeprowadzone w ostatnich latach wykazały, że większość kobiet z nawykowymi poronieniami i przewlekłym zapaleniem błony śluzowej macicy ma przewagę 2-3 lub więcej typów obligatoryjnych beztlenowych mikroorganizmów i wirusów w endometrium.
Według VM Sidelnikovej i in. u kobiet cierpiących na nawykowe poronienia rozpoznanie przewlekłego zapalenia błony śluzowej macicy poza ciążą zostało potwierdzone histologicznie w 73,1% przypadków, a w 86,7% stwierdzono przetrwanie oportunistycznych drobnoustrojów w endometrium, co z pewnością może być przyczyną aktywacji procesów immunopatologicznych. Mieszane przewlekłe zakażenie wirusowe (wirus opryszczki pospolitej, Coxsackie A, Coxsackie B, enterowirusy 68–71, cytomegalowirus) występuje u pacjentek z nawykowymi poronieniami istotnie częściej niż u kobiet z prawidłowym wywiadem położniczym. K. Kohut i in. (1997) wykazali, że odsetek zmian zapalnych w endometrium i tkance doczesnowej u pacjentek z pierwotnym nawracającym poronieniem jest istotnie wyższy niż u kobiet po poronieniu z historią co najmniej jednego porodu donoszonego.
Bakteryjna i wirusowa kolonizacja endometrium zwykle wynika z niezdolności układu odpornościowego i niespecyficznych sił ochronnych organizmu (układ dopełniacza, fagocytoza) do całkowitego wyeliminowania czynnika zakaźnego, a jednocześnie jego rozprzestrzenianie się jest ograniczone przez aktywację limfocytów T (T-helpers, natural killers) i makrofagów. We wszystkich powyższych przypadkach występuje trwałość drobnoustrojów, charakteryzująca się przyciąganiem jednojądrowych fagocytów, NK, T-helpers, syntetyzujących różne cytokiny, do miejsca przewlekłego stanu zapalnego. Najwyraźniej taki stan endometrium uniemożliwia tworzenie się miejscowej immunosupresji w okresie przedimplantacyjnym, która jest niezbędna do utworzenia bariery ochronnej i zapobieżenia odrzuceniu półobcego płodu.
W związku z tym u kobiet z nawykowymi poronieniami przed zajściem w ciążę należy zdiagnozować przewlekłe zapalenie błony śluzowej macicy. Aby ustalić lub wykluczyć tę diagnozę, wykonuje się biopsję endometrium w 7.-8. dniu cyklu miesiączkowego z badaniem histologicznym, PCR i badaniem bakteriologicznym materiału z jamy macicy. Przy weryfikacji diagnozy przewlekłe zapalenie błony śluzowej macicy leczy się według standardów leczenia chorób zapalnych narządów miednicy mniejszej.

