Ekspert medyczny artykułu
Nowe publikacje
Diagnoza choroby zwyrodnieniowej stawów: obrazowanie metodą rezonansu magnetycznego
Ostatnia recenzja: 04.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
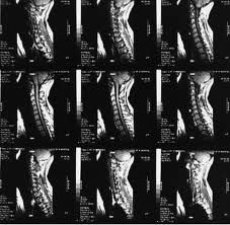
Rezonans magnetyczny (MRI) stał się jedną z wiodących metod nieinwazyjnej diagnostyki choroby zwyrodnieniowej stawów w ostatnich latach. Od lat 70., kiedy zasady rezonansu magnetycznego (MR) zostały po raz pierwszy wykorzystane do badania ludzkiego ciała, ta metoda obrazowania medycznego zmieniła się dramatycznie i nadal szybko ewoluuje.
Udoskonala się sprzęt techniczny i oprogramowanie, opracowuje metody akwizycji obrazu i środki kontrastowe MR. Dzięki temu stale odkrywane są nowe obszary zastosowań MRI. Jeśli na początku jego zastosowanie ograniczało się do badań ośrodkowego układu nerwowego, to obecnie MRI jest z powodzeniem stosowane w niemal wszystkich dziedzinach medycyny.
W 1946 roku grupy badaczy ze Stanford i Harvard University niezależnie odkryły zjawisko zwane jądrowym rezonansem magnetycznym (NMR). Jego istotą było to, że jądra niektórych atomów, znajdujące się w polu magnetycznym, pod wpływem zewnętrznego pola elektromagnetycznego są zdolne do pochłaniania energii, a następnie emitowania jej w postaci sygnału radiowego. Za to odkrycie F. Bloch i E. Parmel otrzymali Nagrodę Nobla w 1952 roku. Nowe zjawisko wkrótce wykorzystano do analizy widmowej struktur biologicznych (spektroskopia NMR). W 1973 roku Paul Rautenburg po raz pierwszy zademonstrował możliwość uzyskania obrazu za pomocą sygnałów NMR. Tak powstała tomografia NMR. Pierwsze tomogramy NMR narządów wewnętrznych żywej osoby zademonstrowano w 1982 roku na Międzynarodowym Kongresie Radiologów w Paryżu.
Należy podać dwa wyjaśnienia. Pomimo faktu, że metoda opiera się na zjawisku NMR, nazywa się ją rezonansem magnetycznym (MR), pomijając słowo „jądrowy”. Robi się tak, aby pacjenci nie mieli myśli o radioaktywności związanej z rozpadem jąder atomowych. I druga okoliczność: tomografy MR nie są przypadkowo „dostrojone” do protonów, czyli jąder wodoru. Tego pierwiastka jest w tkankach bardzo dużo, a jego jądra mają największy moment magnetyczny spośród wszystkich jąder atomowych, co determinuje dość wysoki poziom sygnału MR.
Jeśli w 1983 roku na świecie było tylko kilka urządzeń nadających się do badań klinicznych, to na początku 1996 roku na całym świecie działało około 10 000 tomografów. Co roku do praktyki wprowadza się 1000 nowych urządzeń. Ponad 90% parku tomografów MR to modele z magnesami nadprzewodzącymi (0,5-1,5 T). Ciekawe jest to, że jeśli w połowie lat 80. firmy - producenci tomografów MR kierowały się zasadą „im wyższe pole, tym lepiej”, koncentrując się na modelach z polem 1,5 T i wyższym, to pod koniec lat 80. stało się jasne, że w większości obszarów zastosowań nie mają one znaczących zalet w porównaniu z modelami o średnim natężeniu pola. Dlatego główni producenci tomografów MR (General Electric, Siemens, Philips, Toshiba, Picker, Bruker itp.) obecnie poświęcają wiele uwagi produkcji modeli ze średnimi, a nawet niskimi polami, które różnią się od systemów o wysokim polu zwartością i ekonomicznością przy zadowalającej jakości obrazu i znacznie niższych kosztach. Systemy o wysokim polu są stosowane przede wszystkim w ośrodkach badawczych zajmujących się spektroskopią MR.
Zasada metody MRI
Głównymi elementami skanera MRI są: supermocny magnes, nadajnik radiowy, cewka odbiorcza częstotliwości radiowej, komputer i panel sterowania. Większość urządzeń ma pole magnetyczne z momentem magnetycznym równoległym do długiej osi ciała człowieka. Siłę pola magnetycznego mierzy się w teslach (T). W przypadku klinicznego MRI stosuje się pola o sile 0,2–1,5 T.
Gdy pacjent zostanie umieszczony w silnym polu magnetycznym, wszystkie protony, które są dipolami magnetycznymi, obracają się w kierunku pola zewnętrznego (jak igła kompasu zorientowana w kierunku pola magnetycznego Ziemi). Ponadto osie magnetyczne każdego protonu zaczynają obracać się wokół kierunku zewnętrznego pola magnetycznego. Ten specyficzny ruch obrotowy nazywa się procesją, a jego częstotliwość nazywa się częstotliwością rezonansową. Gdy krótkie elektromagnetyczne impulsy częstotliwości radiowej przechodzą przez ciało pacjenta, pole magnetyczne fal radiowych powoduje, że momenty magnetyczne wszystkich protonów obracają się wokół momentu magnetycznego pola zewnętrznego. Aby tak się stało, częstotliwość fal radiowych musi być równa częstotliwości rezonansowej protonów. Zjawisko to nazywa się rezonansem magnetycznym. Aby zmienić orientację protonów magnetycznych, pola magnetyczne protonów i fal radiowych muszą rezonować, tj. mieć tę samą częstotliwość.
W tkankach pacjenta powstaje moment magnetyczny netto: tkanki są namagnesowane, a ich magnetyzm jest zorientowany ściśle równolegle do zewnętrznego pola magnetycznego. Magnetyzm jest proporcjonalny do liczby protonów na jednostkę objętości tkanki. Ogromna liczba protonów (jąder wodoru) zawartych w większości tkanek oznacza, że moment magnetyczny netto jest wystarczająco duży, aby indukować prąd elektryczny w cewce odbiorczej znajdującej się poza pacjentem. Te indukowane sygnały MR są wykorzystywane do rekonstrukcji obrazu MR.
Proces przejścia elektronów jądra ze stanu wzbudzonego do stanu równowagi nazywa się procesem relaksacji spin-sieć lub relaksacją podłużną. Charakteryzuje się on T1 - czasem relaksacji spin-sieć - czasem potrzebnym do przeniesienia 63% jąder do stanu równowagi po ich wzbudzeniu impulsem 90°. Wyróżnia się również T2 - czas relaksacji spin-spin.
Istnieje kilka metod uzyskiwania tomogramów MR. Różnią się one kolejnością i charakterem generowania impulsów częstotliwości radiowej oraz metodami analizy sygnału MR. Dwiema najszerzej stosowanymi metodami są spin-lattice i spin-echo. Spin-lattice analizuje głównie czas relaksacji T1. Różne tkanki (istota szara i biała mózgu, płyn mózgowo-rdzeniowy, tkanka guza, chrząstka, mięśnie itp.) zawierają protony o różnych czasach relaksacji T1. Intensywność sygnału MR jest związana z czasem trwania T1: im krótszy T1, tym intensywniejszy sygnał MR i tym jaśniejszy dany obszar obrazu pojawia się na monitorze telewizora. Tkanka tłuszczowa jest biała na tomogramach MR, a następnie mózg i rdzeń kręgowy, gęste narządy wewnętrzne, ściany naczyń i mięśnie w kolejności malejącej intensywności sygnału MR. Powietrze, kości i zwapnienia praktycznie nie wytwarzają sygnału MR i dlatego są wyświetlane na czarno. Te zależności czasu relaksacji T1 stwarzają warunki do uwidocznienia tkanek prawidłowych i zmienionych w skanach MRI.
W innej metodzie MRI, zwanej spin-echo, seria impulsów o częstotliwości radiowej jest kierowana na pacjenta, obracając precesujące protony o 90°. Po zatrzymaniu impulsów rejestrowane są sygnały odpowiedzi MRI. Jednak intensywność sygnału odpowiedzi jest inaczej związana z czasem trwania T2: im krótszy T2, tym słabszy sygnał i w konsekwencji mniejsza jasność świecenia na ekranie monitora TV. Tak więc ostateczny obraz MRI uzyskany metodą T2 jest przeciwieństwem tego uzyskanego metodą T1 (ponieważ negatyw jest przeciwieństwem pozytywu).
Tomogramy MRI lepiej niż tomografia komputerowa pokazują tkanki miękkie: mięśnie, warstwy tłuszczu, chrząstki i naczynia krwionośne. Niektóre urządzenia mogą wytwarzać obrazy naczyń krwionośnych bez wstrzykiwania środka kontrastowego (angiografia MRI). Ze względu na niską zawartość wody w tkance kostnej, ta ostatnia nie tworzy efektu ekranowania, jak w przypadku tomografii komputerowej rentgenowskiej, tj. nie zakłóca obrazu, na przykład, rdzenia kręgowego, krążków międzykręgowych itp. Oczywiście jądra wodoru nie są zawarte tylko w wodzie, ale w tkance kostnej są utrwalone w bardzo dużych cząsteczkach i gęstych strukturach i nie zakłócają MRI.
Zalety i wady MRI
Główne zalety MRI to nieinwazyjność, nieszkodliwość (brak narażenia na promieniowanie), trójwymiarowy charakter pozyskiwania obrazu, naturalny kontrast z poruszającej się krwi, brak artefaktów z tkanki kostnej, wysokie różnicowanie tkanek miękkich, możliwość wykonywania spektroskopii MP do badań metabolizmu tkanek in vivo. MRI pozwala na uzyskanie obrazów cienkich warstw ciała człowieka w dowolnym przekroju - w płaszczyznach czołowej, strzałkowej, osiowej i skośnej. Możliwa jest rekonstrukcja obrazów objętościowych narządów, synchronizacja pozyskiwania tomogramów z zębami elektrokardiogramu.
Do głównych wad zalicza się zazwyczaj stosunkowo długi czas potrzebny na uzyskanie obrazów (zwykle kilka minut), co prowadzi do pojawienia się artefaktów od ruchów oddechowych (co szczególnie obniża skuteczność badania płuc), arytmię (w badaniu serca), brak możliwości wiarygodnego wykrycia kamieni, zwapnień, niektórych rodzajów patologii kości, wysoki koszt sprzętu i jego eksploatacji, specjalne wymagania dotyczące pomieszczeń, w których znajdują się urządzenia (ekranowanie przed zakłóceniami), brak możliwości badania pacjentów z klaustrofobią, sztuczne rozruszniki serca, duże metalowe implanty wykonane z metali niemedycznych.
 [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Środki kontrastowe do MRI
Na początku stosowania MRI uważano, że naturalny kontrast między różnymi tkankami eliminuje potrzebę stosowania środków kontrastowych. Wkrótce odkryto, że różnicę sygnałów między różnymi tkankami, czyli kontrast obrazu MR, można znacznie poprawić za pomocą środków kontrastowych. Kiedy pierwszy środek kontrastowy MR (zawierający paramagnetyczne jony gadolinu) stał się dostępny w sprzedaży, zawartość informacji diagnostycznych MRI znacznie wzrosła. Istotą stosowania środków kontrastowych MR jest zmiana parametrów magnetycznych protonów tkanek i narządów, czyli zmiana czasu relaksacji (TR) protonów T1 i T2. Obecnie istnieje kilka klasyfikacji środków kontrastowych MR (czy raczej środków kontrastowych - CA).
Ze względu na dominujący wpływ na czas relaksacji MR-KA dzieli się na:
- T1-CA, które skracają T1 i tym samym zwiększają intensywność sygnału MP tkanki. Są one również nazywane pozytywnymi CA.
- T2-CA, które skracają T2, zmniejszając intensywność sygnału MR. Są to negatywne CA.
W zależności od właściwości magnetycznych MR-CA dzieli się na paramagnetyczne i superparamagnetyczne:
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Środki kontrastowe paramagnetyczne
Właściwości paramagnetyczne posiadają atomy z jednym lub większą liczbą niesparowanych elektronów. Są to jony magnetyczne gadolinu (Gd), chromu, niklu, żelaza i manganu. Związki gadolinu znalazły najszersze zastosowanie kliniczne. Efekt kontrastu gadolinu wynika ze skrócenia czasu relaksacji T1 i T2. W małych dawkach przeważa wpływ na T1, zwiększając intensywność sygnału. W dużych dawkach przeważa wpływ na T2, zmniejszając intensywność sygnału. Paramagnetyki są obecnie najszerzej stosowane w praktyce diagnostyki klinicznej.
Środki kontrastowe superparamagnetyczne
Dominującym efektem tlenku żelaza superparamagnetycznego jest skrócenie relaksacji T2. Wraz ze wzrostem dawki następuje spadek intensywności sygnału. Ferromagnetyczne CA, które obejmują ferromagnetyczne tlenki żelaza strukturalnie podobne do ferrytu magnetytu (Fe 2+ OFe 23+ O 3 ), mogą być również zaliczone do tej grupy CA.
Poniższa klasyfikacja opiera się na farmakokinetyce CA (Sergeev PV i in., 1995):
- pozakomórkowe (niespecyficzne dla tkanek);
- żołądkowo-jelitowy;
- organotropowy (tkankowo-specyficzny);
- makrocząsteczkowe, które służą do określania przestrzeni naczyniowej.
Na Ukrainie znane są cztery MR-CA, które są pozakomórkowymi rozpuszczalnymi w wodzie paramagnetycznymi CA, z których gadodiamid i kwas gadopentetowy są szeroko stosowane. Pozostałe grupy CA (2-4) przechodzą badania kliniczne za granicą.
Pozakomórkowy rozpuszczalny w wodzie MR-CA
Nazwa międzynarodowa |
Wzór chemiczny |
Struktura |
Kwas gadopentetowy |
Gadolinium dimeglumina dietylenotriamina penta-octan ((NMG)2Gd-DTPA) |
Liniowy, jonowy |
Kwas gadoterowy |
(NMG)Gd-DOTA |
Cykliczny, jonowy |
Gadodiamid |
Gadolin dietylenotriaminopentaoctan-bis-metyloamid (Gd-DTPA-BMA) |
Liniowy, niejonowy |
Gadoteridol |
Gd-HP-D03A |
Cykliczny, niejonowy |
CA pozakomórkowe podawane są dożylnie, w 98% wydalane są przez nerki, nie przenikają przez barierę krew-mózg, charakteryzują się niską toksycznością i należą do grupy substancji paramagnetycznych.
Przeciwwskazania do MRI
Do bezwzględnych przeciwwskazań zalicza się stany, w których badanie zagraża życiu pacjentów. Na przykład obecność implantów aktywowanych elektronicznie, magnetycznie lub mechanicznie – są to przede wszystkim sztuczne rozruszniki serca. Narażenie na promieniowanie o częstotliwości radiowej ze skanera MRI może zakłócić pracę rozrusznika serca pracującego w układzie żądania, ponieważ zmiany pól magnetycznych mogą imitować czynność serca. Przyciąganie magnetyczne może również powodować przesunięcie rozrusznika w gnieździe i przesunięcie elektrod. Ponadto pole magnetyczne stwarza przeszkody w działaniu ferromagnetycznych lub elektronicznych implantów ucha środkowego. Obecność sztucznych zastawek serca jest niebezpieczna i stanowi bezwzględne przeciwwskazanie tylko w przypadku badania na skanerach MRI o wysokich polach i jeśli istnieje kliniczne podejrzenie uszkodzenia zastawki. Bezwzględnymi przeciwwskazaniami do badania jest również obecność małych metalowych implantów chirurgicznych (klipsy hemostatyczne) w ośrodkowym układzie nerwowym, ponieważ ich przemieszczenie pod wpływem przyciągania magnetycznego grozi krwawieniem. Ich obecność w innych częściach ciała stanowi mniejsze zagrożenie, ponieważ po leczeniu włóknienie i otoczka zacisków pomagają utrzymać je w stabilności. Jednak oprócz potencjalnego zagrożenia obecność metalowych implantów o właściwościach magnetycznych w każdym przypadku powoduje artefakty, które utrudniają interpretację wyników badania.
Przeciwwskazania do MRI
Absolutny: |
Względny: |
Rozruszniki serca |
Inne środki pobudzające (pompy insulinowe, stymulatory nerwów) |
Implanty ucha środkowego ferromagnetyczne lub elektroniczne |
Implantaty ucha wewnętrznego nieferromagnetyczne, protezy zastawek serca (w polach wysokich, jeśli podejrzewa się dysfunkcję) |
Klipsy hemostatyczne naczyń mózgowych |
Klipsy hemostatyczne w innych lokalizacjach, niewyrównana niewydolność serca, ciąża, klaustrofobia, konieczność monitorowania fizjologicznego |
Przeciwwskazania względne, oprócz wymienionych powyżej, obejmują niewyrównaną niewydolność serca, konieczność monitorowania fizjologicznego (wentylacja mechaniczna, elektryczne pompy infuzyjne). Klaustrofobia jest przeszkodą w badaniu w 1-4% przypadków. Można ją pokonać, z jednej strony, stosując urządzenia z otwartymi magnesami, z drugiej - poprzez szczegółowe wyjaśnienie urządzenia i przebiegu badania. Nie ma dowodów na szkodliwy wpływ MRI na zarodek lub płód, ale zaleca się unikanie MRI w pierwszym trymestrze ciąży. Stosowanie MRI w czasie ciąży jest wskazane w przypadkach, gdy inne niejonizujące metody diagnostyki obrazowej nie dostarczają zadowalających informacji. Badanie MRI wymaga większego udziału pacjenta niż tomografia komputerowa, ponieważ ruchy pacjenta w trakcie badania mają znacznie większy wpływ na jakość obrazów, dlatego badanie pacjentów z ostrą patologią, zaburzeniami świadomości, stanami spastycznymi, demencją, a także dzieci jest często trudne.

