Ekspert medyczny artykułu
Nowe publikacje
Diagnoza etapów przebiegu raka prostaty
Ostatnia recenzja: 04.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Klinicznie rozróżnia się raka zlokalizowanego (T 1-2, N 0, M 0 ), raka miejscowo zaawansowanego (T 3-4, N 0-1, M 0 ) i raka uogólnionego (T 1-4, N 0-1, M 1 ).
Pacjenci z klinicznie zlokalizowanym i miejscowo zaawansowanym stadium choroby są klasyfikowani według stopnia ryzyka (D'Amico A V. i in., 2003):
- niski: stopień T 1a-c; poziom PSA poniżej 10 ig/ml: stopień Gleasona - 2-5; w biopsji - jednostronna zmiana poniżej 50%:
- umiarkowane: stopień T 2a; poziom PSA poniżej 10 ng/ml; wynik Gleasona - 3 + 4 = 7; w biopsji - obustronna zmiana mniejsza niż 50%;
- wysoki stopień zaawansowania T 2b, T 3a-b; poziom PSA - 10-20 ng/ml; stopień Gleasona - powyżej 4 + 3 - 7; w biopsji - uszkodzenie powyżej 50%, naciekanie nerwów;
- bardzo wysoki: stopień T 4; poziom PSA powyżej 20 ng/ml; wynik Gleasona powyżej 8; biopsja wykazuje naciek naczyń limfatycznych.
Po ustaleniu rozpoznania i ustaleniu stopnia zaawansowania procesu (miejscowy, miejscowo zaawansowany lub uogólniony) lekarz i pacjent stają przed wyborem metody leczenia. We współczesnym społeczeństwie dużą wagę przywiązuje się do jakości życia pacjentów po rozpoczęciu leczenia. Jakość życia bez leczenia odpowiada przebiegowi choroby podstawowej i zależy od zaawansowania procesu onkologicznego. Zmiany jakości życia następują głównie po rozpoczęciu leczenia i zastosowaniu jednej z metod terapeutycznych lub chirurgicznych. Jednoznaczne ustalenie stadium procesu pozwala nie tylko wybrać optymalną metodę leczenia, ale także przewidzieć dalszy przebieg choroby.
Określenie poziomu PSA w połączeniu z obrazem klinicznym raka prostaty i stopniem zaawansowania nowotworu według skali Gleasona znacząco zwiększa wartość informacyjną każdego z wymienionych wskaźników w ustalaniu stopnia zaawansowania patologicznego nowotworu. AV Partin i wsp. (1997) zaproponowali tabele prognostyczne pozwalające przewidzieć dalsze rozprzestrzenianie się nowotworu, wybór metody leczenia, stopień radykalności i prognozę skuteczności leczenia.
Aby ocenić rozprzestrzenianie się guza, najczęściej stosowanymi metodami są DRE, TRUS, oznaczenie poziomu PSA i scyntygrafia kości. W razie potrzeby zaleca się tomografię komputerową (TK) lub obrazowanie metodą rezonansu magnetycznego (MRI) i prześwietlenie klatki piersiowej.
Każda z metod obrazowania ma na celu określenie stadium i ocenę skuteczności leczenia. Po potwierdzeniu diagnozy urolog musi wyjaśnić objętość guza pierwotnego, jego granice, inwazyjny lub przerzutowy potencjał guza. Wszystkie te wskaźniki mają ogromne znaczenie dla prognozy choroby i wyboru metody leczenia.
Guz pierwotny (T)
Przede wszystkim należy ustalić, czy guz jest ograniczony do gruczołu krokowego (T 1-2 ), czy też wykracza poza torebkę (T 3-4 ). Badanie palpacyjne często nie pozwala ocenić rozprzestrzenienia się guza. Według niektórych danych wyniki DRE odpowiadają wynikom badania histologicznego u mniej niż 50% pacjentów. Jednak bardziej szczegółowe badanie jest wskazane tylko przy podejmowaniu decyzji o radykalnym leczeniu.
Poziom PSA może odzwierciedlać rozległość guza, ale nie pozwala na dokładne określenie stadium morfologicznego. Połączenie poziomu PSA, indeksu Gleasona i danych palpacyjnych pozwala na lepsze przewidywanie stadium morfologicznego niż każdy z tych parametrów osobno. Wartość wolnego PSA jest kontrowersyjna: w jednym badaniu określenie zawartości wolnego PSA pomogło wyjaśnić stadium w zlokalizowanych guzach, ale inne badania tego nie potwierdziły. Tylko dogłębne badania pomogą rozwiązać ten problem.
Do badania stanu gruczołu krokowego najczęściej stosuje się ultrasonografię przezodbytniczą. Ta metoda może wykryć tylko 60% guzów i nie zawsze wykazuje naciekanie torebki. Prawie 60% pacjentów w stadium T3 . Ultrasonografia wskazuje na mniej powszechny proces. Ultrasonograficznymi objawami naciekania torebki są wybrzuszenie, nierówność i pęknięcie obrysu gruczołu. Naciekanie komórek nowotworowych do pęcherzyków nasiennych jest złym objawem prognostycznym, ale informacja o tym jest niezwykle ważna przy wyborze metody leczenia. Podczas wykonywania TRUS należy zwrócić uwagę na echostrukturę pęcherzyków (hiperechogeniczność), ich asymetrię, deformację i ekspansję. Ponadto uszkodzenie pęcherzyków nasiennych jest widoczne w utracie okrągłości i zagęszczenia u podstawy gruczołu. Objawy te są dość subiektywne, dlatego nie należy polegać wyłącznie na danych ultrasonograficznych. Naciekanie pęcherzyków nasiennych wskazuje na wysokie ryzyko nawrotu miejscowego i przerzutów, a ich biopsja jest wskazana w celu wyjaśnienia (przed operacją). Badanie nie powinno być rozpoczynane od tej procedury, ale jeśli ryzyko inwazji jest wysokie, a wybór leczenia zależy od wyniku biopsji, to jego wdrożenie jest uzasadnione. Wynik ujemny nie wyklucza inwazji mikroskopowej. Z reguły biopsję pęcherzyków nasiennych wykonuje się w stadium klinicznym T 2b i wyższym, a zawartość PSA wynosi ponad 10 ng/ml. Wynik uważa się za dodatni, jeśli przynajmniej jedna biopsja z podstawy gruczołu krokowego zawiera komórki nowotworowe. Nie tylko dodatkowe badania, ale także dokładna analiza wyników biopsji pierwotnej pozwalają zwiększyć dokładność klinicznego określenia stadium (rolę odgrywają liczba i rozległość ognisk guza, inwazja torebki). Ważny jest również stopień zróżnicowania: przy indeksie Gleasona mniejszym niż 6 guz jest zlokalizowany w 70% przypadków.
Przepływ krwi w gruczole krokowym z rakiem jest wyższy niż w normalnym gruczole lub z jego przerostem. Po kastracji intensywność przepływu krwi w gruczole jest zmniejszona. Rozwój map echo-dopplerograficznych do diagnostyki i monitorowania raka prostaty jest obiecujący, ale obecnie nie ma wiarygodnych danych na temat wykorzystania echo-dopplerografii w określaniu stadium procesu miejscowego. Możliwe jest wykorzystanie tej metody do uzyskania dodatkowego materiału podczas biopsji celowanej z ognisk patologicznego unaczynienia.
Wyniki wizualizacji raka prostaty zależą bezpośrednio od wyposażenia technicznego kliniki i doświadczenia specjalisty. Dlatego wszystkie nowoczesne metody wizualizacji odgrywają nie decydującą, ale wyjaśniającą rolę, a wybór metody leczenia opiera się na połączeniu danych z badania klinicznego i badań instrumentalnych.
MRI ma najlepsze możliwości obrazowania struktury gruczołu krokowego. Współczesnym standardem badania narządów miednicy metodą MRI jest zastosowanie czujnika endorektalnego, który pozwala uzyskać obraz o najwyższej możliwej rozdzielczości przestrzennej 0,5-1 mm. Wtłoczenie powietrza do czujnika endorektalnego zapewnia wyraźną wizualizację torebki gruczołu krokowego, kątów odbytniczo-prostatowych i powięzi odbytniczo-prostatowej Denonvilliersa. Zastosowanie czujnika endorektalnego w MRI nie ogranicza wizualizacji regionalnych węzłów chłonnych (do poziomu rozwidlenia aorty brzusznej). Rak prostaty charakteryzuje się niską intensywnością sygnału na obrazach T-ważonych na tle sygnału o wysokiej intensywności z niezmienionej strefy obwodowej gruczołu. Nieregularny kształt, rozproszone rozprzestrzenianie się z efektem masy, rozmyte i nierówne kontury to cechy morfologiczne ognisk o niskiej intensywności sygnału w strefie obwodowej gruczołu krokowego, sugerujące nowotworowy charakter zmiany. Podczas wykonywania dynamicznego kontrastowania, ogniska nowotworowe szybko gromadzą środek kontrastowy w fazie tętniczej i szybko go usuwają, co odzwierciedla stopień angiogenezy i, odpowiednio, stopień złośliwości guza. Niska intensywność sygnału jest również charakterystyczna dla ognisk krwotoków po biopsji, zapalenia gruczołu krokowego, łagodnego rozrostu podścieliska strefy neutralnej gruczołu, zmian włóknisto-bliznowaciejących, rozrostu włóknisto-mięśniowego, następstw terapii hormonalnej lub radioterapii. MRI bez dynamicznego kontrastowania nie pozwala na wiarygodne różnicowanie większości wymienionych zmian i chorób.
Jak wspomniano powyżej, jednym z głównych zadań każdej metody obrazowania raka prostaty jest określenie objętości zmiany gruczołu i rozprzestrzeniania się guza poza torebkę. Określenie objętości guza jest ważne dla rokowania. Objętość guza mniejsza niż 4 cm3 wskazuje na odległe przerzuty, a 12 cm3 wskazuje na niezwykle wysokie prawdopodobieństwo przerzutów. Według badań dokładność MRI w wykrywaniu ognisk zmian nowotworowych gruczołu krokowego waha się od 50 do 90%. Czułość MRI w określaniu lokalizacji raka prostaty wynosi około 70-80%, podczas gdy mikroskopijnych ognisk raka (ognisk) nie można wykryć za pomocą MRI.
Najważniejszą zaletą endorektalnego MRI jest możliwość lokalizacji zmian nowotworowych w obszarach niedostępnych dla innych metod diagnostycznych oraz wyjaśnienia charakteru i kierunku wzrostu guza. Przykładowo, MRI pozwala na wykrycie zmian nowotworowych w przednich częściach strefy obwodowej gruczołu krokowego, niedostępnych w biopsji przezodbytniczej. Generalnie, MRI znacząco uzupełnia dane DRE i TRUS dotyczące lokalizacji guza.
Endorektalny MRI pozwala na wizualizację torebki gruczołu, wiązek naczyniowo-nerwowych, pęcherzyków nasiennych, szczytu gruczołu, splotu żylnego okołoprostatowego i określenie miejscowej częstości występowania guza gruczołu. Należy podkreślić, że penetracja torebki jest uważana za objaw mikroskopowy, a nawet nowoczesne urządzenia MRI (cewka endorektalna) nie są w stanie dostarczyć takich informacji. Możliwe jest jedynie uzyskanie danych o wzroście poza torebką gruczołu.
Kryteria diagnostyczne rozprzestrzenienia się poza torebkę za pomocą MRI:
- obecność guza pozatorebkowego;
- nierówny kontur gruczołu (deformacja, kanciastość);
- asymetria pęczków naczyniowo-nerwowych;
- zniesienie kątów odbytniczo-prostatowych;
- szeroki kontakt guza z torebką.
Najwyższą swoistość (do 95-98%) i dokładność wyników MRI uzyskuje się przy badaniu pacjentów ze średnim lub wysokim ryzykiem naciekania pozatorebkowego. Uważa się, że naciekanie pozatorebkowe (według danych MRI) wskazuje na niewłaściwość leczenia operacyjnego i niekorzystne rokowanie choroby. Hormonalna lub radioterapia nie wpływają na dokładność wykrywania rozprzestrzeniania się pozatorebkowego guza prostaty. Główną trudnością w wykrywaniu ognisk raka i rozprzestrzeniania się pozatorebkowego guza jest duża zmienność interpretacji tomogramów przez różnych specjalistów. Podstawowym zadaniem specjalisty w diagnostyce radiologicznej jest osiągnięcie wysokiej swoistości diagnostycznej (nawet kosztem czułości), aby nie pozbawiać operowanych pacjentów szansy na radykalne leczenie.
Podobieństwo gęstości tkanki nowotworowej, hiperplastycznej i prawidłowej prostaty w TK sprawia, że ta metoda jest mało przydatna do oceny lokalnego rozprzestrzeniania się guza. Inwazja do pęcherzyków nasiennych jest ważniejsza niż inwazja do torebek, ale nawet w tym przypadku TK dostarcza informacji tylko w zaawansowanych przypadkach. Jednak ta metoda jest aktywnie stosowana do oznaczania obszaru uderzenia przed radioterapią.
Powolny rozwój diagnostyki radiologicznej w naszym kraju doprowadził do późnej diagnostyki raka prostaty i w konsekwencji do niewystarczającego rozpowszechnienia radykalnych metod leczenia raka prostaty (np. prostatektomii), niskiej dostępności nowoczesnych tomografów i braku odpowiednich programów szkoleniowych dla specjalistów diagnostyki radiologicznej i urologów. Pomimo faktu, że TK i MRI są obecnie powszechne, poziom wyposażenia gabinetów i wykształcenia specjalistów diagnostyki radiologicznej jest niewystarczający, aby uzyskane informacje mogły stać się decydujące przy wyborze metody leczenia pacjentów z rakiem prostaty.
Węzły chłonne regionalne (N)
Regionalne węzły chłonne należy oceniać tylko wtedy, gdy ma to bezpośredni wpływ na strategię leczenia (zwykle podczas planowania radykalnego leczenia). Wysokie poziomy PSA, guzy T2c -T3a, słabe różnicowanie i naciekanie okołonerwowe są związane z wysokim ryzykiem przerzutów do węzłów chłonnych. Ocena stanu węzłów chłonnych na podstawie poziomów PSA jest uważana za niewystarczającą.
Tylko limfadenektomia (otwarta lub laparoskopowa) dostarcza niezbędnych informacji. Ostatnie badania rozszerzonej limfadenektomii wykazały, że rak prostaty nie zawsze dotyczy węzłów chłonnych zasłonowych. W bezobjawowych guzach i poziomach PSA poniżej 20 kg/ml. TK potwierdza powiększone węzły chłonne tylko w 1% przypadków. Zastosowanie MRI lub TK jest uzasadnione w przypadkach wysokiego ryzyka przerzutów, ponieważ swoistość tych metod sięga 93-96%. Jednak nawet pozytywny wynik przy ich użyciu może być fałszywy, a jedynie nakłucie podejrzanego węzła chłonnego pozwala odmówić limfadenektomii. Zgodnie z analizą retrospektywną, wielkość węzła chłonnego nie zawsze wskazuje na obecność w nim przerzutów; asymetria dotkniętych węzłów chłonnych jest uważana za bardziej pouczający znak. Obecnie u zaledwie 2–3% pacjentów, u których wykonano radykalną prostatektomię z powodu ograniczonego raka prostaty, na podstawie pooperacyjnego badania histologicznego rozpoznaje się przerzuty do węzłów chłonnych.
Tomografia pozytonowa (PET) i scyntygrafia z zastosowaniem znakowanych przeciwciał są zalecane jako metody wykrywania przerzutów do węzłów chłonnych, jednak ich zastosowanie jest wciąż ograniczone ze względu na niewystarczającą czułość.
Nomogramy Partina (2001) mogą być wykorzystane do oceny ryzyka zajęcia regionalnych węzłów chłonnych. Nomogramy to algorytmy matematyczne, które są stosowane dla konkretnego pacjenta lub grupy pacjentów. Tabele te pozwalają określić prawdopodobieństwo lokalnego rozprzestrzenienia się guza (do torebki, pęcherzyków nasiennych) i zajęcia węzłów chłonnych na podstawie stopnia zaawansowania klinicznego, poziomu PSA i wskaźnika Gleasona. W szczególności umożliwiają one identyfikację grupy pacjentów z niskim (mniej niż 10%) prawdopodobieństwem przerzutów do węzłów chłonnych (z poziomem PSA powyżej 20 ng/md, stopniem T 1-2a i wskaźnikiem Gleasona 2-6); w tej grupie stan węzłów chłonnych może nie być określony przed radykalnym leczeniem. Ryzyko przerzutów do węzłów chłonnych można również ocenić poprzez wykrycie obszarów guza z wyraźną anaplazją (4-5 punktów): jeśli takie obszary są obecne w czterech lub więcej biopsjach lub przeważają w co najmniej jednej biopsji, ryzyko sięga 20-45%. U pozostałych chorych nie przekracza 2,5%. W takich przypadkach nie jest wymagane dodatkowe badanie.
Przerzuty odległe (M)
U 85% pacjentów umierających na raka prostaty wykrywane są zmiany szkieletu osiowego. Przerzuty do kości powstają w wyniku wnikania komórek nowotworowych do szpiku kostnego z krwią, co prowadzi do wzrostu guza i rozpadu struktur kostnych. Występowanie przerzutów do kości wpływa na rokowanie, a ich wczesne wykrycie ostrzega lekarza o możliwych powikłaniach. W 70% przypadków przerzuty łączą się ze wzrostem aktywności kostnego izoenzymu fosfatazy alkalicznej (ALP). Oznaczenie aktywności ALP i poziomu PSA w zdecydowanej większości przypadków pozwala nam wykryć przerzuty do kości. Według analizy wieloczynnikowej na wskaźniki te wpływa jedynie liczba przerzutów do kości. Ważne jest, że aktywność kostnego izoenzymu ALP odzwierciedla stopień uszkodzenia kości dokładniej niż poziom PSA.
Scyntygrafia jest uważana za najczulszą metodę wykrywania przerzutów do kości (jest lepsza od radiografii i oznaczania aktywności fosfatazy alkalicznej i kwaśnej). Difosfoniany technetu są lepiej wykorzystywane jako lek radiofarmaceutyczny, ponieważ ich gromadzenie się w kościach jest znacznie bardziej aktywne niż w tkankach miękkich. Wykazano korelację między półilościową oceną uszkodzeń kości a przeżyciem. Wykrycie odległych przerzutów jest możliwe w każdym narządzie. Najczęściej występują w węzłach chłonnych pozaregionalnych, płucach, wątrobie, mózgu i skórze. W przypadku odpowiednich dolegliwości i objawów do ich wykrycia stosuje się prześwietlenie klatki piersiowej, USG, TK i MRI. Taktykę postępowania w przypadku podejrzenia przerzutów do kości przedstawiono na schemacie.
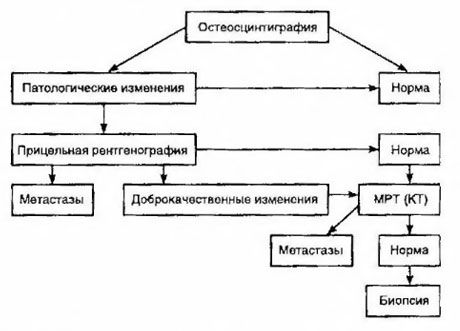
Najbardziej wiarygodnym wskaźnikiem laboratoryjnym, który pomaga określić stopień przerzutów, jest poziom PSA. Wykazano, że jego wzrost powyżej 100 ng/ml jest jedynym parametrem, który wiarygodnie wskazuje na przerzuty odległe. Określenie poziomu PSA zmniejsza liczbę pacjentów, u których konieczne jest wykonanie scyntygrafii kości. Prawdopodobieństwo wykrycia przerzutów do kości przy spadku poziomu PSA jest bardzo niskie. W przypadku braku dolegliwości i początkowej zawartości PSA poniżej 20 ng/ml, wykrycia guzów wysoko i średnio zróżnicowanych, można uniknąć scyntygrafii. Jednocześnie w przypadku guzów słabo zróżnicowanych i naciekania torebki, wskazana jest scyntygrafia (niezależnie od poziomu PSA).


 [
[