Neuroleptyki lub leki przeciwpsychotyczne
Last reviewed: 24.06.2018

Stosujemy ścisłe wytyczne dotyczące źródeł i linkujemy wyłącznie do renomowanych stron medycznych, placówek badawczych oraz, w miarę możliwości, do badań recenzowanych przez specjalistów medycznych. Należy pamiętać, że liczby w nawiasach ([1], [2] itd.) to klikalne linki do tych badań.
Jeśli uważasz, że którakolwiek z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, zaznacz ją i naciśnij Ctrl + Enter.
Leki przeciwpsychotyczne (neuroleptyki) to klasa leków psychotropowych stosowanych głównie w leczeniu schizofrenii. Obecnie powszechnie rozróżnia się dwie grupy (lub kategorie) leków: typowe i atypowe leki przeciwpsychotyczne. Poniżej znajdują się informacje na temat właściwości farmakologicznych, wskazań do stosowania i skutków ubocznych terapii dla każdej z tych grup leków.
Wskazania do stosowania typowych leków przeciwpsychotycznych
Obecnie główne wskazania do przepisywania tradycyjnych neuroleptyków, według zaleceń uznanych badaczy w dziedzinie psychofarmakoterapii, obejmują:
- Łagodzenie pobudzenia psychoruchowego i zaburzeń zachowania wywołanych przez ciężkie objawy psychotyczne. W takich przypadkach wskazane jest stosowanie doustnych lub pozajelitowych form leków o działaniu przeciwpsychotycznym, zarówno globalnym (klopromazyna, lewomepromazyna, tioproperazyna, zuklopentyksol), jak i selektywnym – w postaci wpływu na zaburzenia halucynacyjno-paranoidalne (haloperidol, trifluoperazyna).
- Terapia antynawrotowa (zapobiegawcza). W tym celu przepisuje się formy depot leków, zwłaszcza u pacjentów ze słabym przestrzeganiem zaleceń lekarskich (haloperidol decanoate, przedłużona forma flupentiksolu), lub małe lub średnie dawki leków w celu uzyskania efektu odhamowującego (przeciwnegatywnego), spośród tych leków, których duże dawki są stosowane w celu łagodzenia ostrych zaburzeń psychotycznych (flupentiksol, zuklopentyksol). W tym typie terapii zaleca się również przepisywanie tzw. małych neuroleptyków (tiorydazyna, chloroprotiksen, sulpiryd), których działanie psychotropowe polega na wpływie na objawy biegunki depresyjnej i zaburzenia snu.
- Przełamanie oporności terapeutycznej na atypowe leki przeciwpsychotyczne w leczeniu ostrych stanów psychotycznych. W tym celu stosuje się zazwyczaj pozajelitowe formy tradycyjnych leków przeciwpsychotycznych o globalnym (chlorpromazyna, lewomepromazyna itp.) i selektywnym (haloperidol) działaniu przeciwpsychotycznym.
Leki te powodują różne skutki uboczne, których charakter zależy od cech profilu farmakologicznego każdego leku. Leki przeciwpsychotyczne o wyraźniejszym działaniu cholinolitycznym częściej powodują zaburzenia akomodacji, zaparcia, suchość w ustach i zatrzymanie moczu. Działanie uspokajające jest bardziej typowe dla leków przeciwpsychotycznych o wyraźnym działaniu przeciwhistaminowym, a niedociśnienie ortostatyczne jest bardziej typowe dla leków blokujących receptory a1-adrenergiczne. Blokada transmisji cholinergicznej, nordrenergicznej i dopaminergicznej przez typowe neuroleptyki może prowadzić do szeregu zaburzeń w sferze seksualnej, takich jak brak miesiączki lub bolesne miesiączkowanie, anorgazmia, mlekotok, obrzęk i bolesność gruczołów piersiowych oraz zmniejszona potencja. Skutki uboczne w sferze seksualnej są związane głównie z właściwościami cholinolitycznymi i adrenolitycznymi tych leków, a także ze wzrostem wydzielania prolaktyny z powodu blokady metabolizmu dopaminy. Najpoważniejszymi skutkami ubocznymi typowych neuroleptyków są dysfunkcje motoryczne. Są one najczęstszym powodem, dla którego pacjenci przerywają przyjmowanie leków. Trzy główne skutki uboczne terapii związane z wpływem na sferę motoryczną to wczesne zespoły pozapiramidowe, późna dyskineza i NMS.
Uważa się, że zespoły pozapiramidowe są związane z blokadą receptorów D2 w jądrach podstawy. Należą do nich dystonia, parkinsonizm neuroleptyczny i akatyzja. Objawy ostrej reakcji dystonicznej (wczesnej dyskinezy) obejmują nagle rozwijającą się hiperkinezę, kryzysy okulogyryczne, skurcze mięśni twarzy i tułowia, opistotonus. Zaburzenia te są zależne od dawki i często występują po 2-5 dniach terapii bardzo silnymi neuroleptykami, takimi jak haloperidol i flufenazyna. Aby złagodzić wczesną dyskinezę, zmniejsza się dawkę neuroleptyku i przepisuje się leki antycholinergiczne (biperyden, triheksyfenidyl). Późna dyskineza zwykle obejmuje mięśnie szyi i, w przeciwieństwie do ostrej reakcji dystonicznej, jest mniej podatna na leczenie lekami antycholinergicznymi. Parkinsonizm neuroleptyczny charakteryzuje się zmniejszonymi spontanicznymi zdolnościami motorycznymi, hipo- i amimią, drżeniem spoczynkowym i sztywnością. Ważne jest, aby odróżnić te objawy od pozornie podobnych negatywnych zaburzeń w schizofrenii, które są reprezentowane przez emocjonalne wyobcowanie, przytępienie afektu i anergię. Aby skorygować te skutki uboczne, wskazane jest stosowanie leków antycholinergicznych, zmniejszenie dawki neuroleptyku lub zastąpienie go atypowym lekiem przeciwpsychotycznym. Akatyzja objawia się wewnętrznym lękiem, niemożnością pozostania w jednym miejscu przez długi czas i koniecznością ciągłego poruszania rękami lub nogami. Aby ją złagodzić, stosuje się leki antycholinergiczne i centralne beta-blokery (propranolol).
Późna dyskineza objawia się mimowolnymi ruchami dowolnej grupy mięśni, najczęściej mięśni języka i ust. Klinicznie wyróżnia się kilka jej postaci: dyskineza mięśni policzków, języka, ust (okresowe skurcze mięśni żucia, tworzące wrażenie grymasującej osoby, język może mimowolnie wysuwać się z ust pacjenta); dystonia późna i akatyzja późna; (pacjent wykonuje ruchy choreoatetotyczne głowy, tułowia, kończyn górnych i dolnych). Tę postać zaburzenia odnotowuje się głównie podczas długotrwałego leczenia tradycyjnymi neuroleptykami i wykrywa się ją u około 15-20% pacjentów przyjmujących je jako terapię podtrzymującą. Prawdopodobnie u niektórych pacjentów ryzyko wystąpienia objawów dyskinezy jest zwiększone, ponieważ niektóre z nich obserwowano w klinice schizofrenii jeszcze przed „erą neuroleptyczną”. Ponadto dyskinezę późną opisano u kobiet w podeszłym wieku i pacjentów z zaburzeniami afektywnymi. Uważa się, że dyskineza późna jest związana ze wzrostem liczby receptorów dopaminy w prążkowiu, chociaż układy GABAergiczne i inne układy neuroprzekaźników prawdopodobnie również biorą udział w jej patogenezie. Nie ma skutecznego uniwersalnego leczenia takich skutków ubocznych. Sugeruje się, że niskie dawki neuroleptyków o dużej sile działania blokującego dopaminę lub witamina E mogą mieć umiarkowanie korzystny wpływ na te zaburzenia. Najskuteczniejszym sposobem leczenia dyskinezji późnej jest zmniejszenie dawki typowego neuroleptyku lub zastąpienie go atypowym lekiem przeciwpsychotycznym.
Według aktualnych danych, złośliwy zespół neuroleptyczny występuje w około 0,5% przypadków psychofarmakoterapii. Prawdopodobnie rzadkie występowanie takiego zagrażającego życiu powikłania można obecnie wyjaśnić powszechnym wprowadzeniem do praktyki atypowych leków przeciwpsychotycznych, ponieważ ryzyko rozwoju NMS podczas leczenia tymi lekami jest nieznaczne. Powszechnie przyjmuje się, że główną przyczyną rozwoju NMS jest nadmierna blokada układu dopaminergicznego podczas terapii neuroleptykami, zwłaszcza po zwiększeniu dawki silnie działającego leku przeciwpsychotycznego. Głównymi objawami NMS są hipertermia, zwiększone napięcie mięśni szkieletowych i odruchy ścięgniste, zaburzenia świadomości z przejściem w śpiączkę. Badania krwi ujawniają leukocytozę, zwiększoną OB, aktywność aminotransferaz wątrobowych; badania moczu ujawniają obecność albuminurii. Zaburzenia równowagi wodno-elektrolitowej występują szybko, co stwarza przesłanki do powstania obrzęku mózgu. NMS jest ostrym stanem wymagającym pilnej hospitalizacji pacjenta w celu intensywnej terapii infuzyjnej. W leczeniu NMS najważniejsze jest nawodnienie i leczenie objawowe. W tej sytuacji wszelkie przepisane neuroleptyki wymagają natychmiastowego odstawienia. W niektórych przypadkach agonisty receptora dopaminy (na przykład bromokryptyna) lub środki zwiotczające mięśnie mają pozytywny wpływ, chociaż ich skuteczność nie została zbadana. Po wyeliminowaniu NMS nie należy wznawiać stosowania neuroleptyku przez co najmniej dwa tygodnie. Następnie można przepisać lek przeciwpsychotyczny o niskiej mocy, najlepiej lek nowej generacji. Dawkę nowo przepisanego leku należy zwiększać niezwykle ostrożnie, monitorując stan funkcji życiowych i dane laboratoryjne (badania krwi i moczu).
Typowe neuroleptyki rzadko powodują niebezpieczne, śmiertelne powikłania. Objawy przedawkowania są głównie związane z indywidualnym profilem działania przeciwadrenergicznego i antycholinergicznego leku. Ponieważ leki te mają silne działanie przeciwwymiotne, w celu ich eliminacji z organizmu wskazane jest płukanie żołądka, a nie podawanie środków wymiotnych. Niedociśnienie tętnicze jest z reguły konsekwencją blokady receptorów adrenergicznych i powinno być korygowane przez podawanie dopaminy i noradrenaliny. W przypadku zaburzeń rytmu serca wskazane jest stosowanie lidokainy.
Mechanizm działania i efekty farmakologiczne typowych leków przeciwpsychotycznych
Wraz z rozwojem psychofarmakologii zaproponowano różne opcje dotyczące wpływu leków przeciwpsychotycznych na neuroreceptory. Główną hipotezą pozostaje, że wpływają one na neurostruktury dopaminy (głównie receptory D2), opierając się na danych dotyczących zaburzenia prawidłowego metabolizmu dopaminy w strukturach mózgu w psychozach. Receptory dopaminy D2 znajdują się w zwojach podstawy mózgu, jądrze półleżącym i korze czołowej; odgrywają wiodącą rolę w regulacji przepływu informacji między korą mózgową a wzgórzem.
Rysunek przedstawia bardziej szczegółowe zrozumienie zaburzeń przekazywania dopaminy w obszarach korowych i podkorowych mózgu oraz roli tych zaburzeń w rozwoju objawów schizofrenii (opracowano na podstawie monografii Jones RB, Buckley PF, 2006).
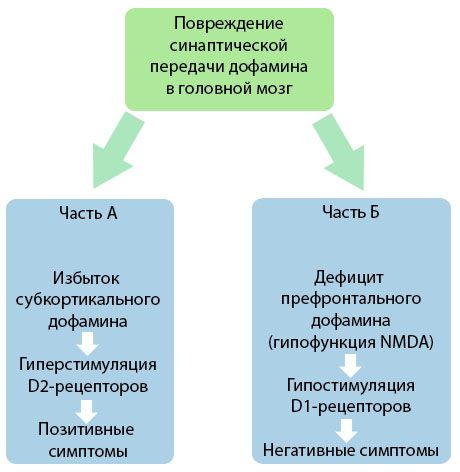
Część A odzwierciedla klasyczną, wczesną teorię dopaminy, postulującą nadmiar dopaminy w obszarach podkorowych i hiperstymulację receptorów D2, co prowadzi do pojawienia się produktywnych objawów. Część B pokazuje późniejszą modernizację teorii na początku lat 90. Dane uzyskane w tym czasie ujawniły, że niedobór dopaminy w receptorach D, wraz z niewystarczającą stymulacją tych receptorów w korze przedczołowej, prowadzi do pojawienia się negatywnych objawów i deficytów poznawczych. Dlatego też, zgodnie ze współczesnym rozumieniem, oba typy zaburzeń transmisji dopaminergicznej - nadmiar podkorowej dopaminy i jej niedobór w korze przedczołowej - są połączonym wynikiem zakłócenia transmisji synaptycznej w obszarze przedczołowym i są związane z niedoczynnością N-metylo-N-asparaginianu. Oprócz początkowo wyizolowanej dopaminy, później zidentyfikowano inne neuroprzekaźniki zaangażowane w patogenezę schizofrenii, takie jak serotonina, kwas gamma-aminomasłowy, glutaminian, noradrenalina, acetylocholina i różne neuropeptydy. Chociaż rola tych mediatorów nie została w pełni zbadana, niemniej jednak w miarę rozwoju wiedzy staje się jasne, że manifestacją licznych zmian neurochemicznych w organizmie są liczne zmiany. Dlatego też działanie kliniczne leku przeciwpsychotycznego jest sumą efektów na różne formacje receptorowe i prowadzi do eliminacji zaburzeń homeostazy.
W ostatnich latach, dzięki pojawieniu się nowych metod badawczych, takich jak wiązanie ligandów radioizotopowych i skanowanie PET, poczyniono znaczny postęp w wyjaśnianiu subtelnego biochemicznego mechanizmu działania neuroleptyków. W szczególności określono porównawczą siłę i tropizm leków wiążących się z poszczególnymi neuroreceptorami w różnych obszarach i strukturach mózgu. Wykazano bezpośrednią zależność nasilenia działania przeciwpsychotycznego leku od siły jego efektu blokującego na różne receptory dopaminergiczne. Ostatnio zidentyfikowano cztery typy takich receptorów:
- Guzy D1 zlokalizowane są głównie w obszarze istoty czarnej i prążkowia (tzw. obszar nigrostriatalny) oraz w okolicy przedczołowej;
- D2 - w obszarach nigrostriatalnym, mezolimbicznym i przednim płacie przysadki mózgowej (wydzielanie prolaktyny);
- D3 (presynaptyczny) – w różnych strukturach mózgu kontroluje aktywność dopaminergiczną zgodnie z prawem ujemnego sprzężenia zwrotnego;
- D4 (presynaptyczny) – głównie w obszarach nigrostriatalnym i mezolimbicznym.
Jednocześnie można obecnie uznać za udowodnione, że to blokada receptorów D2 powoduje rozwój efektów przeciwpsychotycznych, wtórnie uspokajających, a także pozapiramidowych działań niepożądanych. Inne kliniczne objawy blokady tego typu receptorów to działanie przeciwbólowe i przeciwwymiotne neuroleptyków (zmniejszenie nudności, wymiotów w wyniku zahamowania ośrodka wymiotnego), a także zmniejszenie zawartości hormonu wzrostu i zwiększenie produkcji prolaktyny (neuroendokrynne działania niepożądane, w tym mlekotok i nieregularne miesiączki). Długotrwała blokada nigrostriatalnych receptorów D2 prowadzi do pojawienia się ich nadwrażliwości, która odpowiada za rozwój późnych dyskinez i „psychoz nadwrażliwości”. Prawdopodobne kliniczne objawy blokady presynaptycznych receptorów D3 i D4 wiążą się głównie ze stymulującym działaniem neuroleptyków. Ze względu na częściową blokadę tych receptorów w obszarach nigrostriatalnym i mezolimbokortycznym, neuroleptyki aktywujące i tnące (silne, wysoce aktywne) w małych dawkach mogą stymulować, a w dużych dawkach hamować przekaźnictwo dopaminergiczne.
W ostatnich latach zainteresowanie funkcją układów serotoninergicznych mózgu, w tym receptorów serotoninowych, gwałtownie wzrosło. Faktem jest, że w różnych częściach mózgu układ serotoninergiczny ma modulujący wpływ na struktury dopaminergiczne. W szczególności w obszarze mezokortykalnym serotonina hamuje uwalnianie dopaminy, a zatem blokada postsynaptycznych receptorów 5-HT prowadzi do wzrostu zawartości dopaminy. Jak wiadomo, rozwój objawów negatywnych w schizofrenii wiąże się z niedoczynnością neuronów dopaminowych w przedczołowych strukturach kory mózgowej. Obecnie znanych jest około 15 typów centralnych receptorów 5-HT. Eksperymentalnie odkryto, że neuroleptyki wiążą się głównie z receptorami 5-HT pierwszych trzech typów.
Leki te mają głównie działanie stymulujące (agonistyczne) na receptory 5-HT1a. Prawdopodobne konsekwencje kliniczne: zwiększona aktywność przeciwpsychotyczna, zmniejszenie nasilenia zaburzeń poznawczych, korekcja objawów negatywnych, działanie przeciwdepresyjne i zmniejszenie częstości występowania działań niepożądanych o charakterze pozapiramidowym.
Istotne znaczenie ma wpływ neuroleptyków na receptory 5-HT2, zwłaszcza na podtypy 5-HT2a. Znajdują się one głównie w korze mózgowej, a ich wrażliwość jest zwiększona u pacjentów ze schizofrenią. Zdolność neuroleptyków nowej generacji do zmniejszania nasilenia objawów negatywnych, poprawy funkcji poznawczych, regulacji snu poprzez wydłużenie całkowitego czasu trwania faz snu wolnofalowego (fala D), zmniejszania agresji i łagodzenia objawów depresyjnych i bólów głowy przypominających migrenę (wynikających z zaburzeń naczyniowo-mózgowych) wiąże się z blokadą receptorów 5-HT2a. Z drugiej strony, przy blokadzie receptorów 5-HT2a możliwe są efekty hipotensyjne i zaburzenia ejakulacji u mężczyzn.
Uważa się, że wpływ neuroleptyków na receptory 5-HT2c wywołuje efekt uspokajający (przeciwlękowy), zwiększenie apetytu (któremu towarzyszy wzrost masy ciała) oraz zmniejszenie produkcji prolaktyny.
Receptory 5-HT3 zlokalizowane są głównie w układzie limbicznym. Gdy dochodzi do ich zablokowania, w pierwszej kolejności pojawia się działanie przeciwwymiotne, a nasileniu ulega również działanie przeciwpsychotyczne i przeciwlękowe.
Występowanie objawów parkinsonizmu zależy również od siły blokowania receptorów muskarynowych cholinergicznych przez lek. Działanie cholinolityczne i blokujące dopaminę pozostają w pewnym stopniu w wzajemnych relacjach. Wiadomo na przykład, że w regionie nigrostriatalnym receptory D2 hamują uwalnianie acetylocholiny. Gdy ponad 75% receptorów D2 w regionie nigrostriatalnym jest zablokowanych, równowaga zostaje zaburzona na korzyść układu cholinergicznego. Jest to powód korygującego działania leków antycholinergicznych (korektorów) na neuroleptyczne działania niepożądane pozapiramidowe. Chlorprotiksen, klozapina i olanzapina mają duże powinowactwo do receptorów muskarynowych i praktycznie nie powodują działań niepożądanych pozapiramidowych, ponieważ blokują jednocześnie receptory cholinergiczne i dopaminergiczne. Haloperidol i pochodne fenotiazyny piperazyny mają wyraźny wpływ na receptory dopaminy, ale bardzo słaby wpływ na receptory choliny. Wynika to z ich zdolności do wywoływania wyraźnych pozapiramidowych działań niepożądanych, które ulegają zmniejszeniu przy stosowaniu bardzo dużych dawek, gdy efekt cholinolityczny staje się zauważalny. Oprócz zmniejszenia blokującego wpływu dopaminy na receptory D2 regionu nigrostriatalnego i zniesienia pozapiramidowych działań niepożądanych, silne działanie cholinergiczne może powodować pogorszenie funkcji poznawczych, w tym zaburzenia pamięci, a także obwodowe działania niepożądane (suchość błon śluzowych, upośledzenie akomodacji wzrokowej, zaparcia, zatrzymanie moczu, splątanie itp.). Neuroleptyki mają dość silny efekt blokujący na receptory histaminowe typu I, co wiąże się przede wszystkim z nasileniem działania uspokajającego, a także wzrostem masy ciała z powodu zwiększonego apetytu. Działanie przeciwalergiczne i przeciwświądowe neuroleptyków wiąże się również z ich właściwościami przeciwhistaminowymi.
Oprócz blokowania dopaminy, działania antyserotoninergicznego, cholinolitycznego i przeciwhistaminowego, większość neuroleptyków ma właściwości adrenolityczne, tj. blokują zarówno centralne, jak i obwodowe receptory a1-adrenergiczne. Adrenoblokery, takie jak chloropromazyna i chloroprotiksen, mają wyraźne działanie uspokajające. Ponadto działanie blokujące tych leków może powodować neurowegetatywne skutki uboczne (niedociśnienie tętnicze, tachykardię itp.), a także nasilenie hipotensyjnego działania adrenoblokerów.
Prace wielu autorów dostarczają danych na temat siły wiązania (powinowactwa) poszczególnych neuroleptyków z różnymi typami neuroreceptorów.
Na podstawie profilu działania neurochemicznego typowe i atypowe leki przeciwpsychotyczne, spośród tych najczęściej stosowanych w praktyce klinicznej, można warunkowo podzielić na sześć grup.
Pierwszą grupę stanowią selektywne blokery receptorów D2 i D4 (sulpiryd, amisudpryd, haloperydol itp.) z grupy pochodnych benzamidu i butyrofenonu. W małych dawkach, głównie dzięki blokadzie presynaptycznych receptorów D4, aktywują dopaminergiczne przekazywanie impulsów nerwowych i działają pobudzająco (rozhamowująco), w dużych dawkach blokują receptory D2 we wszystkich obszarach mózgu, co klinicznie objawia się wyraźnym działaniem przeciwpsychotycznym, a także działaniami niepożądanymi o charakterze pozapiramidowym i endokrynnym (spowodowanym prolaktynemią).
Do drugiej grupy zaliczają się wysoce aktywne blokery receptorów D2, a także leki słabo lub umiarkowanie blokujące receptory 5-HT2a i 5-HT1a (flupentiksol, flufenazyna, zuklopentyksol itp.), czyli głównie pochodne piperazyny fenotiazyny lub zbliżone do nich strukturą stereochemiczną tioksanteny. Podobnie jak leki z pierwszej grupy, neuroleptyki te wykazują przede wszystkim wyraźne działanie przeciwpsychotyczne (przerywające), a także powodują pozapiramidowe efekty pye i prolaktynemię. W małych dawkach wykazują umiarkowanie aktywujące (psychostymulujące) działanie.
Trzecią grupę stanowią poliwalentne neuroleptyki uspokajające, które blokują większość neuroreceptorów w sposób niezróżnicowany. Leki te mają wyraźnie wyrażony efekt blokujący receptory dopaminy, a także powodują silne działanie adrenolityczne i cholinolityczne. Obejmuje to większość neuroleptyków uspokajających, przede wszystkim alifatyczne i piperydynowe pochodne fenotiazyny, a także zbliżone do nich strukturą stereochemiczną tioksanteny (chlorpromazyna, lewomepromazyna, chloroprotiksen itp.). W spektrum działania psychotropowego tych leków dominuje przede wszystkim wyraźne pierwotne działanie uspokajające, rozwijające się niezależnie od stosowanej dawki, oraz umiarkowane działanie przeciwpsychotyczne. Ponadto, ze względu na wyraźne działanie antycholinergiczne, leki z tej grupy powodują słabe lub umiarkowane działania niepożądane o charakterze pozapiramidowym i neuroendokrynologicznym, ale często prowadzą do rozwoju niedociśnienia ortostatycznego i innych reakcji autonomicznych z powodu wyraźnej blokady receptorów a1-adrenergicznych.
Do czwartej grupy zaliczają się neuroleptyki, które blokują receptory D2 i 5-HT2a w sposób zrównoważony, tj. w takim samym stopniu (te ostatnie w nieco większym stopniu) oraz receptory a1-adrenergiczne w umiarkowanym stopniu. Do tej grupy zaliczają się przedstawiciele nowej generacji atypowych leków przeciwpsychotycznych (risperidon, ziprasidon, sertindol), które mają różną strukturę chemiczną. Mechanizm neurochemiczny działania determinuje ich selektywny wpływ przede wszystkim na obszary mezolimbiczne i mezokortykalne mózgu. Obok wyraźnego działania przeciwpsychotycznego, braku lub słabej ekspresji pozapiramidowych działań niepożądanych (przy stosowaniu dawek terapeutycznych), słabej lub umiarkowanej prolaktynemii i umiarkowanych właściwości adrenolitycznych (reakcje hipotensyjne), ta grupa neuroleptyków jest w stanie korygować objawy negatywne poprzez pośrednią stymulację przekaźnictwa dopaminergicznego w korze mózgowej.
Piąta grupa składa się z poliwalentnych atypowych leków przeciwpsychotycznych o trójpierścieniowej dibenzodiazepinie lub podobnej strukturze (klozapina, olanzapina i kwetiapina). Podobnie jak leki z trzeciej grupy, blokują większość neuroreceptorów w sposób niezróżnicowany. Jednak receptory 5-HT2a są blokowane silniej niż receptory D2 i D4, zwłaszcza te zlokalizowane w regionie nigrostriatalnym. Determinuje to rzeczywisty brak lub słabe działanie pozapiramidowe i brak działań niepożądanych neuroendokrynnych związanych ze zwiększoną produkcją prolaktyny z wyraźnym działaniem przeciwpsychotycznym i zdolnością do zmniejszania nasilenia objawów negatywnych. Ponadto wszystkie leki z tej grupy mają wyraźne właściwości adrenolityczne i przeciwhistaminowe, co determinuje działanie uspokajające i hipotensyjne. Klozapina i olanzapina mają również dość wyraźne działanie blokujące na receptory muskarynowe i prowadzą do rozwoju działań niepożądanych cholinolitycznych.
Zatem jedyną wspólną cechą biochemiczną wszystkich neuroleptyków zaliczanych do tych grup jest zdolność blokowania postsynaptycznych receptorów dopaminergicznych i jednoczesnego zwiększania syntezy i metabolizmu dopaminy.
Szósta grupa obejmuje jedyny atypowy lek przeciwpsychotyczny, aripiprazol, który pojawił się na krajowym rynku psychofarmakologicznym stosunkowo niedawno. Lek ten jest częściowym agonistą receptorów D2-dopaminowych i działa jako funkcjonalny antagonista w stanie hiperdopaminergicznym oraz jako funkcjonalny agonista w profilu hipodopaminergicznym. Taki unikalny profil receptorowy aripiprazolu umożliwia zmniejszenie ryzyka zaburzeń pozapiramidowych i hiperprolaktynemii podczas jego stosowania. Ponadto aripiprazol działa jako częściowy agonista receptorów 5-HT1a i jednocześnie jest antagonistą receptorów 5-HT2a. Przyjmuje się, że taka interakcja z receptorami prowadzi do ogólnie zrównoważonego funkcjonowania układów serotoninowego i dopaminowego, więc mechanizm działania aripiprazolu można określić jako stabilizujący układ dopaminowo-serotoninowy.
Tak więc obecny poziom wiedzy na temat neurochemicznych mechanizmów działania neuroleptyków pozwala nam zaproponować nową, patogenetycznie bardziej uzasadnioną klasyfikację farmakodynamiczną tej grupy leków psychotropowych. Zastosowanie tej klasyfikacji pozwala nam w dużym stopniu przewidywać spektrum aktywności psychotropowej, tolerancji i prawdopodobnych interakcji lekowych konkretnego leku. Innymi słowy, cechy aktywności neurochemicznej leku w dużym stopniu determinują cechy jego aktywności klinicznej, które należy uwzględnić przy wyborze konkretnego leku przeciwpsychotycznego dla konkretnego pacjenta.
Skuteczność globalnego działania przeciwpsychotycznego dowolnego neuroleptyku ocenia się za pomocą tzw. ekwiwalentu chloropromazyny, który przyjmuje się jako 1. Przykładowo ekwiwalent chloropromazyny haloperidolu = 50. Oznacza to, że skuteczność przeciwpsychotyczna 1 mg haloperidolu jest porównywalna do 50 mg chloropromazyny. Na podstawie tego wskaźnika opracowano klasyfikację, która przewiduje podział neuroleptyków o wysokiej (ekwiwalent chloropromazyny > 10,0), średniej (ekwiwalent chloropromazyny = 1,0-10,0) i niskiej (ekwiwalent chloropromazyny = 1,0) aktywności przeciwpsychotycznej, zwanej patentnością. Typowe neuroleptyki (antypsychotyki pierwszej generacji) są szeroko stosowane w klinicznej psychofarmakoterapii od prawie pół wieku. Spektrum ich działania terapeutycznego obejmuje:
- globalne działanie przeciwpsychotyczne w postaci zdolności do równomiernego i zróżnicowanego łagodzenia różnych objawów psychozy:
- pierwotne działanie uspokajające (hamujące) – zdolność leku do szybkiego łagodzenia pobudzenia psychoruchowego;
- selektywne, wybiórcze działanie przeciwpsychotyczne, objawiające się zdolnością wpływania na poszczególne objawy: majaczenie, halucynacje, rozhamowanie popędów itp.;
- działanie neurotropowe aktywujące (rozhamowujące, odhamowujące, przeciwautystyczne), objawiające się rozwojem objawów pozapiramidowych;
- działanie somatotropowe w postaci rozwoju działań niepożądanych neuroendokrynnych i wegetatywnych;
- działanie depresyjne, wyrażające się w zdolności niektórych leków przeciwpsychotycznych do wywoływania objawów depresyjnych.
Skuteczność leków przeciwpsychotycznych pierwszej generacji w leczeniu nie tylko zaburzeń psychotycznych, ale także zaburzeń w obrębie psychiatrii borderline została wielokrotnie udowodniona i jest niezaprzeczalna. Dlatego też, pomimo wysokiej częstości występowania skutków ubocznych terapii, gdy są przepisywane, nadal są stosowane w praktyce medycznej.
Skutki uboczne terapii przeciwpsychotycznej
W tabeli wymieniono główne działania niepożądane atypowej terapii przeciwpsychotycznej.
Przygotowanie |
|
Zaburzenia przewodzenia w EKG |
Zaburzenia metaboliczne (zwiększenie masy ciała, zwiększenie stężenia glukozy, cholesterolu, trójglicerydów we krwi) |
||
Klozapina |
. |
++ |
++ |
++- |
|
Risperidon |
++ |
+/- |
++ |
+/- |
|
Olanzapina |
+ |
+/- |
+++ |
++ |
+++ |
Kwetiapina |
+/- |
+ |
+/- |
--- |
|
Zyprazydon |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulpryd |
++ |
+/- |
|||
Uwaga. Nasilenie skutków ubocznych: „+++” – wysokie; „++” – średnie; „+” – niskie; „+/-” – wątpliwe; „-” – nieobecne.
Zespoły pozapiramidowe
Jedną z głównych cech atypowych leków przeciwpsychotycznych, w przeciwieństwie do tradycyjnych, jest ich niska zdolność do wywoływania zespołów pozapiramidowych, co stało się przełomem w farmakoterapii podtrzymującej schizofrenii. Jednak, jak wynika z danych w tabeli, przy stosowaniu poszczególnych leków z tej serii (risperidon, amisulpryd) mogą wystąpić takie objawy, co wymaga szczególnej uwagi przy ich przepisywaniu.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Nieprawidłowości EKG
Możliwość wystąpienia działań niepożądanych ze strony serca stanowi poważny problem przy stosowaniu niektórych nowoczesnych leków przeciwpsychotycznych w terapii. W takich przypadkach mówimy o wydłużeniu odstępu QT, co może prowadzić do rozwoju arytmii. Zaburzenia przewodzenia, przede wszystkim wydłużenie odstępu QT, najczęściej obserwuje się podczas leczenia klozapiną, sertindolem, ziprasidonem. Współistniejące patologie w postaci bradykardii, bloku przedsionkowo-komorowego, niedoczynności tarczycy mogą przyczyniać się do wystąpienia tego powikłania podczas terapii ww. lekami. Obecnie zaleca się monitorowanie EKG mniej więcej raz na 3 miesiące u pacjentów otrzymujących terapię podtrzymującą atypowymi lekami przeciwpsychotycznymi.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Zaburzenia endokrynologiczne
Obecnie największe obawy budzi zdolność atypowych leków przeciwpsychotycznych do powodowania przyrostu masy ciała. Zwiększona masa ciała, poziom glukozy i trójglicerydów we krwi może prowadzić do zaburzeń metabolicznych i rozwoju cukrzycy typu 2. Podczas terapii klozapiną i olanzapiną konieczne jest zachowanie szczególnej ostrożności i cotygodniowe monitorowanie parametrów biochemicznych. Według J. Geddesa i in. (2000), PB Jonesa, PF Buckleya (2006) należy uznać za stosowne przeprowadzenie dokładnego badania pacjentów przed przepisaniem im konkretnego leku przeciwpsychotycznego współczesnej generacji, ponieważ wiadomo, że zaburzenia metaboliczne częściej występują u pacjentów, którzy przed rozpoczęciem leczenia mieli predyspozycje dziedziczne, nadmierną masę ciała, zaburzenia spektrum lipidowego i hiperglikemię. Algorytm monitorowania zaproponowany przez PB Jonesa, PF Buckleya (2006) obejmuje kilka punktów.
- Zebranie wywiadu medycznego i czynników rodzinnych dotyczących ryzyka zaburzeń metabolicznych.
- Rejestracja wskaźnika masy ciała, EKG, ciśnienia tętniczego i tętna przed rozpoczęciem leczenia.
- Zbieranie danych laboratoryjnych (poziom glukozy, profil lipidowy, cholesterol) przed rozpoczęciem terapii.
- Regularne monitorowanie wskaźnika masy ciała i parametrów życiowych w trakcie leczenia.
- Monitorowanie danych laboratoryjnych w trakcie leczenia.
Występowanie hiperprolaktynemii podczas terapii przeciwpsychotycznej jest spowodowane centralną blokadą receptorów dopaminowych w podwzgórzu, co prowadzi do uwolnienia prolaktyny z przedniego płata przysadki mózgowej. Hiperprolaktynemia najczęściej występuje podczas leczenia olanzapiną, risperidonem i amisulprydem.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocytoza
Kolejne poważne powikłanie terapii przeciwpsychotycznej. Można je zaobserwować podczas leczenia klozapiną i olanzapiną. Według J. Geddesa i in. (2000) rozpoznano je w ciągu pierwszych 3 miesięcy u 1-2% pacjentów przyjmujących te leki. W związku z tym zaleca się cotygodniowe badania krwi u pacjentów przyjmujących te leki w ciągu pierwszych 18 tygodni terapii oraz comiesięczne monitorowanie w późniejszym okresie. Wykazano, że po zmniejszeniu dawki wyżej wymienionych neuroleptyków kliniczne badanie krwi wraca do normy. Jednocześnie należy uznać, że do tej pory nie ma jasnej strategii postępowania dla pacjentów, u których występują wyżej wymienione działania niepożądane związane z zaburzeniami metabolicznymi. Najczęściej jeden atypowy lek przeciwpsychotyczny jest zastępowany innym. Innym obiecującym kierunkiem jest wyznaczanie specjalnej terapii korygującej, w szczególności stosowanie bromokryptyny w celu korygowania hiperprolaktynemii. Idealną sytuacją jest taka, w której opieka nad pacjentem z takimi zaburzeniami jest prowadzona przy okresowym udziale internistów, w szczególności endokrynologów, kardiologów i innych specjalistów.
Podsumowując, należy stwierdzić, że jeśli zachowane zostaną podane algorytmy dawkowania i monitorowania nie tylko stanu psychicznego, ale i fizycznego pacjentów, stosowanie leków drugiej generacji jest bezpieczniejsze niż stosowanie klasycznych neuroleptyków.
Wiele innych leków przeciwpsychotycznych jest obecnie w fazie rozwoju. Leki nowej generacji prawdopodobnie będą miały inny mechanizm działania (na przykład profil GABAergiczny) i będą mogły wpływać na różne objawy schizofrenii, w tym zaburzenia deficytowe właściwe.
Atypowe leki przeciwpsychotyczne
Współczesne wytyczne zawierają dane na temat zalet stosowania leków przeciwpsychotycznych drugiej generacji w farmakoterapii. Termin „atypowy” (synonim - leki przeciwpsychotyczne drugiej generacji) jest warunkowy i jest stosowany głównie dla wygody oznaczania nowej generacji. W porównaniu z tradycyjnymi neuroleptykami leki z tej grupy są skuteczniejsze w korygowaniu zaburzeń negatywnych, afektywnych i poznawczych, co łączy się z lepszą tolerancją i mniejszym ryzykiem objawów pozapiramidowych. Różnice w charakterze efektu terapeutycznego jednego lub drugiego leku z serii atypowych leków przeciwpsychotycznych tłumaczy się, podobnie jak w grupie typowych neuroleptyków, jego indywidualnym profilem działania farmakologicznego.
Aby wyjaśnić możliwości psychofarmakoterapii atypowymi lekami przeciwpsychotycznymi, warto skupić się na lekach z tej grupy zarejestrowanych w Rosji.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Klozapina (dibenzodiazepina)
Założyciel grupy atypowych leków przeciwpsychotycznych. Mechanizm działania klozapiny charakteryzuje się lekką blokadą receptorów D2 przy jednoczesnym wysokim antagonizmie receptorów 5-HT2a, a1, a2-adrenergicznych i H1-histaminowych. Udowodniono, że jest skutecznym lekiem przeciwpsychotycznym w przypadkach oporności na inne leki przeciwpsychotyczne (lek z grupy rezerwowej), a także jest wskazany w leczeniu przewlekłej manii, pobudzenia psychotycznego, agresji. W praktyce domowej klozapina jest często przepisywana w celu uzyskania sedacji i jako środek nasenny u pacjentów psychotycznych. Należy uznać, że takie zastosowanie klozapiny nie odpowiada jej głównemu profilowi wskazań do stosowania w terapii. Prawdopodobnie należy zrewidować stosunek do tego leku przeciwpsychotycznego jako leku o drugorzędnym znaczeniu, ponieważ obecnie jest to jedyny lek o udowodnionej skuteczności u pacjentów opornych.
Klozapina, w przeciwieństwie do typowych neuroleptyków, nie powoduje poważnych zaburzeń pozapiramidowych ze względu na wspomniane niskie powinowactwo do receptorów O2. Okazało się również, że może być stosowana w leczeniu późnej dystonii i ciężkiej akatyzji. Ze względu na niskie ryzyko wystąpienia NMS, klozapina może być uważana za lek z wyboru u pacjentów, którzy wcześniej cierpieli na to powikłanie.
Jednak podczas terapii klozapiną może wystąpić szereg poważnych działań niepożądanych. Najgroźniejszym z nich (nawet przy przepisywaniu małych dawek) jest agranulocytoza, która występuje u 0,5–1,0% pacjentów. Inne ważne działania niepożądane, które mogą wystąpić podczas stosowania leku, to senność, nadmierne ślinienie się i przyrost masy ciała, która często jest już podwyższona w momencie przepisywania klozapiny pod wpływem wcześniejszej terapii przeciwpsychotycznej. Należy również zwrócić uwagę na możliwość wystąpienia tachykardii, niedociśnienia tętniczego i napadów padaczkowych podczas przyjmowania leku. Prawdopodobieństwo wystąpienia napadów zależy od dawki. Ich ryzyko znacznie wzrasta, jeśli dawka klozapiny przekroczy 600 mg/dobę. Rozwój napadów nie jest przeciwwskazaniem do dalszego stosowania leku, ale wymaga zmniejszenia dawki o połowę i przepisania leków przeciwdrgawkowych, takich jak kwas walproinowy. Zapobieganie skutkom ubocznym leczenia klozapiną obejmuje staranne monitorowanie liczby białych krwinek, a także parametrów EKG i endokrynologicznych.
Przedawkowanie klozapiny może powodować depresję świadomości aż do rozwoju śpiączki, a także objawy związane z działaniem cholinolitycznym (tachykardia, majaczenie), napady padaczkowe, depresję oddechową, zespoły pozapiramidowe. Przyjęcie dawki przekraczającej 2500 mg leku może zakończyć się zgonem.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidon
Pochodna benzizoksazolu o wysokim powinowactwie do receptorów Dj serotoniny i dopaminy, z dominującym wpływem na układ serotoninowy. Lek ma szeroki zakres wskazań do stosowania, w tym łagodzenie zaostrzeń, leczenie przeciwnawrotowe, terapia pierwszego epizodu psychotycznego i korygowanie negatywnych objawów schizofrenii. Wykazano, że lek poprawia funkcjonowanie poznawcze u pacjentów ze schizofrenią. Uzyskano wstępne dane, że risperidon zmniejsza również współistniejące objawy afektywne u pacjentów ze schizofrenią i może być lekiem pierwszego wyboru w leczeniu zaburzeń afektywnych dwubiegunowych.
Skutki uboczne terapii risperidonem, zwłaszcza zaburzenia pozapiramidowe, zależą od dawki i występują częściej przy dawkach przekraczających 6 mg/dobę. Inne skutki uboczne obejmują nudności, wymioty, lęk, senność i zwiększone stężenie prolaktyny w surowicy. Długotrwałe stosowanie risperidonu może prowadzić do zwiększenia masy ciała i rozwoju cukrzycy typu 2, ale z mniejszym prawdopodobieństwem w porównaniu z klozapiną, olanzapiną.
Przedawkowanie może powodować senność, napady padaczkowe, wydłużenie odstępu QT i poszerzenie zespołu QRS oraz niedociśnienie tętnicze. Opisano przypadki śmiertelne z powodu przedawkowania risperidonu.
Niewątpliwą zaletą leku jest dostępność form płynnych i szybko rozpuszczających się (podjęzykowych), których stosowanie przyspiesza wchłanianie leku do organizmu pacjenta i ułatwia kontrolę nad jego przyjmowaniem. Istnieje również przedłużona forma leku - proszek do sporządzania zawiesiny do podawania domięśniowego (consta-risperidon w mikrosferach). Jest on zalecany w leczeniu podtrzymującym pacjentów ze schizofrenią, szczególnie u pacjentów słabo współpracujących. Należy wziąć pod uwagę fakt, że lek potrzebuje około trzech tygodni, aby dostać się do krwiobiegu, dlatego rozpoczynając terapię consta-risperidonem, pacjent musi dodatkowo przyjmować doustną postać risperidonu przez co najmniej 3 tygodnie po pierwszym wstrzyknięciu.
Olanzapina
Pod względem działania farmakologicznego jest zbliżony do klozapiny, ponieważ ma plejomorficzny profil receptorowy ze znacznym powinowactwem do receptorów serotoninowych, muskarynowych, a1-adrenergicznych i histaminowych. Aktywność terapeutyczna olanzapiny ma cechy podobne do skuteczności klozapiny i risperidonu pod względem wpływu na pozytywne, negatywne i depresyjne objawy schizofrenii. Jednocześnie uzyskano dane o większej skuteczności olanzapiny w porównaniu z innymi atypowymi lekami przeciwpsychotycznymi u pacjentów z pierwszym epizodem psychotycznym i w korekcji wskaźników funkcjonowania poznawczego. Należy wziąć pod uwagę, że na początku terapii z zastosowaniem postaci tabletkowej leku może wystąpić szybki efekt rozhamowania ze zwiększonym pobudzeniem psychoruchowym i lękiem. Dlatego w leczeniu napadów, którym towarzyszy silne pobudzenie psychoruchowe, wskazane jest stosowanie postaci iniekcyjnej leku.
Olanzapina rzadko powoduje zaburzenia pozapiramidowe lub dyskinezę późną, a najczęstszymi działaniami niepożądanymi związanymi z jej stosowaniem są zaburzenia metaboliczne i przyrost masy ciała. Ustalono, że pacjenci otrzymujący olanzapinę dość często doświadczają podwyższonego poziomu cholesterolu, lipidów w osoczu i predyspozycji do cukrzycy typu 2, ale takie efekty były równie powszechne u pacjentów otrzymujących zarówno olanzapinę, jak i klozapinę. Jednocześnie uzyskano dane pokazujące, że przyrost masy ciała koreluje z pozytywną reakcją na olanzapinę (tj. służy jako ważny wskaźnik prognostyczny terapii) i rozwija się w otyłość tylko u 20-30% pacjentów, którzy przybrali nadwagę w trakcie leczenia.
Przedawkowanie może powodować sedację, toksyczne działanie antycholinergiczne, napady padaczkowe i niedociśnienie tętnicze. Obecnie nie ma przekonujących danych pozwalających ocenić ryzyko zgonu z powodu przedawkowania.
Kwetiapina
Jest klasyfikowany jako związek dibenzotiazepinowy. Jego profil receptorowy jest w dużej mierze podobny do klozapiny. Poziom wiązania kwetiapiny do receptorów D2 jest niski (mniej niż 50%) i krótkotrwały nawet przy stosowaniu dużych dawek. Lek jest skuteczny w leczeniu pozytywnych, negatywnych i ogólnych objawów schizofrenii. Istnieją dowody na jego skuteczne stosowanie zarówno w przypadkach dużej oporności na terapię, jak i w celu poprawy funkcjonowania poznawczego pacjentów, co daje prawo do zalecenia go jako leku przeciwpsychotycznego pierwszego rzutu w terapii podtrzymującej schizofrenii. Wreszcie kwetiapina ma umiarkowane działanie przeciwdepresyjne, aktywujące. Dlatego jest wskazany w leczeniu napadów depresyjno-urojeniowych i zaburzeń koła senesto-hipochondrycznego.
Udowodniona wysoka aktywność tymotropowa kwetiapiny wyjaśnia fakt, że jest ona zarejestrowana jako środek do łagodzenia i wtórnej profilaktyki zaburzeń depresyjnych. W leczeniu epizodów maniakalnych w przebiegu zaburzeń afektywnych dwubiegunowych typu I i II kwetiapina jest stosowana jako dodatkowy środek. Brak form iniekcyjnych w pewnym stopniu ogranicza jej stosowanie u pacjentów z pobudzeniem i agresywnym zachowaniem.
Kwetiapina jest dobrze tolerowana, praktycznie nie powoduje zespołów pozapiramidowych, poza przypadkami stosowania maksymalnych dawek. Kwetiapina nie powoduje hiperprolaktynemii, rzadziej niż olanzapina i klozapina, prowadzi do zwiększenia masy ciała i upośledzenia tolerancji glukozy.
Zyprazydon
Posiada unikalny profil aktywności receptorowej. Będąc silnym antagonistą receptorów 5HT2a i receptorów D2, jest również aktywnym inhibitorem wychwytu zwrotnego serotoniny i noradrenaliny. Badania kliniczne wykazały znaczną wyższość ziprasidonu w jego działaniu na objawy psychotyczne i przejawy agresji w porównaniu z haloperidolem. Istnieją również dane na temat pozytywnego wpływu ziprasidonu na funkcje poznawcze pacjentów ze schizofrenią, a także na współistniejące objawy afektywne, wskaźniki funkcjonowania społecznego. Ziprasidon jest zwykle dobrze tolerowany i bardzo rzadko powoduje zespoły pozapiramidowe, przyrost masy ciała i zaburzenia metaboliczne. Częściej występuje wydłużenie odstępu QT powyżej 460 ms, dlatego wskazane jest, aby pacjenci przyjmujący ten lek poddali się badaniu EKG zarówno przed przepisaniem leku, jak i monitorowaniu kontrolnemu w trakcie leczenia. Szczególną uwagę należy zwrócić na leczenie skojarzone (przyjmowanie leków przeciwarytmicznych), które może nasilać wydłużenie odstępu QT i prowadzić do rozwoju arytmii serca, migotania komór.
Sertindol
Należy do pochodnych fenyloindolu. Wykazuje wysoki antagonizm funkcjonalny w stosunku do receptorów D2, serotoninowych (zwłaszcza 5-HT2a-receptorów) i a1-adrenergicznych. Zgodnie z badaniami elektroneurochemicznymi sertindol selektywnie hamuje receptory dopaminowe w brzusznej części segmentalnej. Taka selektywność, najprawdopodobniej, zapewnia niskie ryzyko zespołów pozapiramidowych i hiperprolaktynemii podczas stosowania leku. Wyniki badań porównawczych wykazały, że sertindol jest porównywalny z haloperidolem pod względem aktywności przeciwpsychotycznej. Lek ma wyraźne działanie rozhamowujące u pacjentów z objawami negatywnymi i depresyjnymi, co przewyższa podobne działanie rispoleptu. Istnieją również dowody potwierdzające skuteczność sertindolu w korekcji zaburzeń poznawczych u pacjentów ze schizofrenią. Sertindol jest na ogół dobrze tolerowany przez pacjentów, rzadko powoduje sedację i dlatego zaleca się go jako lek zastępczy w przypadku wystąpienia działań niepożądanych podczas terapii innymi nowoczesnymi lekami przeciwpsychotycznymi.
Do poważnych skutków ubocznych zalicza się zdolność leku do wydłużania odstępu QT, co może prowadzić do arytmii serca. Podczas analizy badań po wprowadzeniu leku na rynek stało się jasne, że profil sercowy sertindolu nie różni się od profilu innych leków przeciwpsychotycznych nowej generacji.
Arypiprazol
Ma działanie przeciwpsychotyczne porównywalne z innymi lekami atypowymi, ale wywiera większy wpływ na parametry funkcjonowania poznawczego pacjentów ze schizofrenią. Wspomniane wyżej unikalne działanie farmakologiczne leku – częściowego agonisty receptorów D2 – pozwala na zmniejszenie ryzyka zespołów pozapiramidowych i hiperprolaktynemii podczas jego stosowania.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulpryd
Należy do klasy podstawionych benzamidów. Lek selektywnie wiąże się z podtypami receptorów dopaminergicznych D2 i D3, nie wykazuje powinowactwa do podtypów D1, D4 i D5, a także do receptorów serotoninowych, H1-histaminowych, a1-adrenergicznych i cholinergicznych. Stosowany w dużych dawkach blokuje postsynaptyczne receptory D2. W małych dawkach jego działanie rozhamowujące objawia się blokadą presynaptycznych receptorów D2, D3, dzięki czemu jego stosowanie jest również skuteczne w leczeniu objawów negatywnych, chociaż nie jest łączonym antagonistą receptorów D2 i receptorów serotoninowych. Wyniki szeregu badań wskazują na wyraźną aktywność przeciwpsychotyczną leku przy stosowaniu w dużych dawkach, co przewyższa tradycyjne leki.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
