Ekspert medyczny artykułu
Nowe publikacje
Patogeneza wirusowego zapalenia wątroby typu B
Ostatnia recenzja: 07.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
W patogenezie zapalenia wątroby typu B można wyróżnić kilka głównych ogniw łańcucha patogenetycznego:
- wprowadzenie patogenu - zakażenie;
- utrwalenie na hepatocytach i wniknięcie do wnętrza komórki;
- namnażanie się wirusa i jego „wypchnięcie” na powierzchnię hepatocytu, a także do krwi;
- aktywacja reakcji immunologicznych mających na celu wyeliminowanie patogenu;
- uszkodzenie narządów i układów przez kompleksy immunologiczne;
- kształtowanie odporności, uwolnienie od patogenu, wyzdrowienie.
Ponieważ zakażenie wirusem zapalenia wątroby typu B zawsze następuje pozajelitowo, można uznać, że moment zakażenia jest praktycznie równoważny z momentem wniknięcia wirusa do krwi. Próby niektórych badaczy, aby odróżnić fazę enteralną i regionalną w zapaleniu wątroby typu B, są słabo uzasadnione. Istnieje więcej przesłanek, aby sądzić, że wirus natychmiast przedostaje się do wątroby wraz z krwią.
Tropizm wirusa zapalenia wątroby typu B do tkanki wątroby jest z góry określony przez obecność specjalnego receptora w HBsAg - polipeptydu o masie cząsteczkowej 31 000 Da (P31), który ma aktywność wiążącą albuminę. Podobna strefa albuminowa znajduje się również na błonie hepatocytów w wątrobie człowieka i szympansa, co zasadniczo decyduje o tropizmie HBV do wątroby człowieka i szympansa.
Gdy wirus wnika do hepatocytu, uwalniane jest wirusowe DNA, które wnikając do jądra hepatocytu i działając jako matryca do syntezy kwasów nukleinowych, uruchamia serię kolejnych reakcji biologicznych, których wynikiem jest złożenie nukleokapsydu wirusa. Nukleokapsyd migruje przez błonę jądrową do cytoplazmy, gdzie następuje ostateczne złożenie cząstek Dane'a - kompletnego wirusa zapalenia wątroby typu B.
Należy jednak zauważyć, że gdy hepatocyt jest zakażony, proces może przebiegać na dwa sposoby – replikacyjnie i integracyjnie. W pierwszym przypadku rozwija się obraz ostrego lub przewlekłego zapalenia wątroby, a w drugim – nosicielstwa wirusa.
Powody, które determinują dwa typy interakcji między wirusowym DNA a hepatocytami, nie zostały dokładnie ustalone. Najprawdopodobniej typ odpowiedzi jest uwarunkowany genetycznie.
Wynikiem interakcji replikacyjnej jest złożenie rdzeniowych struktur antygenowych (w jądrze) i złożenie kompletnego wirusa (w cytoplazmie), po czym następuje prezentacja kompletnego wirusa lub jego antygenów na błonie lub w strukturze błony hepatocytu.
Powszechnie przyjmuje się, że replikacja wirusa nie powoduje uszkodzenia komórek na poziomie hepatocytów, ponieważ wirus zapalenia wątroby typu B nie ma działania cytopatycznego. Stanowiska tego nie można uznać za niepodważalne, ponieważ opiera się na danych eksperymentalnych, które, chociaż wskazują na brak działania cytopatycznego wirusa zapalenia wątroby typu B, zostały uzyskane w hodowlach tkankowych i dlatego nie można ich w pełni ekstrapolować na wirusowe zapalenie wątroby typu B u ludzi. W każdym razie kwestia braku uszkodzenia hepatocytów w fazie replikacyjnej wymaga dodatkowych badań.
Jednak niezależnie od charakteru interakcji wirusa z komórką, wątroba jest koniecznie włączona w proces immunopatologiczny. W tym przypadku uszkodzenie hepatocytów wiąże się z faktem, że w wyniku ekspresji antygenów wirusowych na błonie hepatocytów i uwolnienia antygenów wirusowych do swobodnego krążenia włącza się łańcuch kolejnych reakcji odpornościowych komórkowych i humoralnych, ostatecznie ukierunkowanych na usunięcie wirusa z organizmu. Proces ten odbywa się w pełnej zgodności z ogólnymi wzorcami odpowiedzi immunologicznej na zakażenia wirusowe. Aby wyeliminować patogen, włącza się reakcje cytotoksyczne komórek, w których pośredniczą różne klasy komórek efektorowych: komórki K, komórki T, naturalni zabójcy, makrofagi. Podczas tych reakcji dochodzi do zniszczenia zakażonych hepatocytów, czemu towarzyszy uwolnienie antygenów wirusowych (HBcAg, HBeAg, HBsAg), które uruchamiają układ genezy przeciwciał, w wyniku czego we krwi gromadzą się specyficzne przeciwciała, przede wszystkim do rdzenia - anty-HBc i e-antygenu - anty-HBE. W konsekwencji dochodzi do uwolnienia komórki wątrobowej od wirusa w procesie jej obumierania na skutek reakcji cytolizy komórkowej.
Jednocześnie specyficzne przeciwciała gromadzące się we krwi wiążą antygeny wirusa, tworząc kompleksy immunologiczne fagocytowane przez makrofagi i wydalane przez nerki. W tym przypadku mogą wystąpić różne uszkodzenia kompleksów immunologicznych w postaci kłębuszkowego zapalenia nerek, zapalenia tętnic, bólu stawów, wysypki skórnej itp. Przy udziale specyficznych przeciwciał następuje oczyszczenie organizmu z patogenu i całkowite wyzdrowienie.
Zgodnie z zarysowaną koncepcją patogenezy zapalenia wątroby typu B, całą różnorodność wariantów klinicznych przebiegu choroby tłumaczy się zazwyczaj osobliwościami interakcji wirusa i współpracy komórek immunokompetentnych, innymi słowy, siłą odpowiedzi immunologicznej na obecność antygenów wirusowych. Według współczesnych koncepcji siła odpowiedzi immunologicznej jest uwarunkowana genetycznie i powiązana z antygenami zgodności tkankowej locus HLA pierwszej klasy.
Ogólnie przyjmuje się, że w warunkach odpowiedniej odpowiedzi immunologicznej na antygeny wirusa ostre zapalenie wątroby rozwija się klinicznie z cyklicznym przebiegiem i całkowitym wyzdrowieniem. Na tle spadku odpowiedzi immunologicznej na antygeny wirusa cytoliza immunologiczna jest wyrażona nieznacznie, dlatego nie dochodzi do skutecznej eliminacji zakażonych komórek wątroby, co prowadzi do łagodnych objawów klinicznych z długotrwałym utrzymywaniem się wirusa i ewentualnie rozwojem przewlekłego zapalenia wątroby. Jednocześnie, wręcz przeciwnie, w przypadku genetycznie uwarunkowanej silnej odpowiedzi immunologicznej i masywnej infekcji (hemotransfuzji), powstają rozległe obszary uszkodzenia komórek wątroby, które klinicznie odpowiadają ciężkim i złośliwym postaciom choroby.
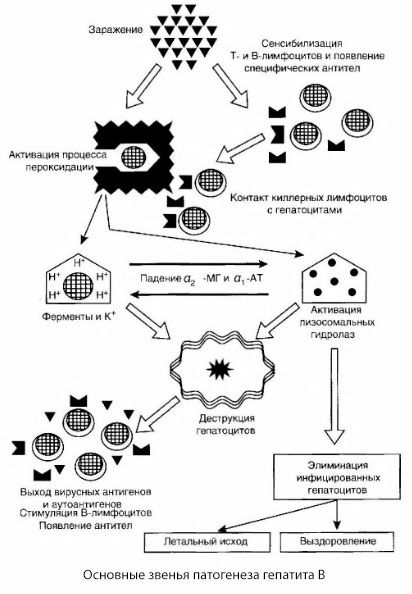
Przedstawiony schemat patogenezy zapalenia wątroby typu B wyróżnia się spójnością, zawiera jednak szereg kontrowersyjnych i słabo zbadanych punktów.
Jeśli przyjmiemy koncepcję zapalenia wątroby typu B jako choroby immunopatologicznej, możemy spodziewać się wzrostu reakcji cytotoksyczności komórkowej wraz ze wzrostem ciężkości choroby. Jednak w ciężkich postaciach wskaźniki komórkowego powiązania odporności są gwałtownie obniżone, w tym wielokrotny spadek w porównaniu z tymi u zdrowych dzieci, a także wskaźnik cytotoksyczności komórek K. W postaci złośliwej, w okresie rozwoju masywnej martwicy wątroby, a zwłaszcza śpiączki wątrobowej, obserwuje się całkowitą niezdolność limfocytów do transformacji blastycznej pod wpływem fitohematolutyniny, endotoksyny gronkowcowej i HBsAg. Ponadto nie ma zdolności leukocytów do migracji zgodnie z reakcją hamowania migracji leukocytów (LMIC), a wyniki ich badań z wykorzystaniem fluorescencyjnej sondy tetracyklinowej ujawniają gwałtowny wzrost przepuszczalności błon limfocytów.
Tak więc, jeśli wskaźniki fluorescencji limfocytów u zdrowych ludzi wynoszą 9,9±2%, a w typowym zapaleniu wątroby typu B o łagodnym przebiegu wzrastają do 22,3±2,7%, to w postaciach złośliwych liczba limfocytów fluorescencyjnych osiąga średnio 63,5±5,8%. Ponieważ wzrost przepuszczalności błon komórkowych jest jednoznacznie oceniany w literaturze jako wiarygodny wskaźnik ich niższości funkcjonalnej, można wnioskować, że w zapaleniu wątroby typu B, zwłaszcza w postaci złośliwej, dochodzi do poważnych uszkodzeń limfocytów. Świadczą o tym również wskaźniki cytotoksyczności komórek K. W postaci ciężkiej w 1-2 tygodniu choroby cytotoksyczność wynosi 15,5±8,8%, a w postaci złośliwej w 1 tygodniu - 6,0±2,6, w 2 tygodniu - 22,0±6,3% przy normie 44,8±2,6%.
Przedstawione dane wyraźnie wskazują na wyraźne zaburzenia w komórkowym powiązaniu odporności u pacjentów z ciężkimi postaciami zapalenia wątroby typu B. Oczywiste jest również, że zmiany te występują wtórnie, w wyniku uszkodzenia komórek immunokompetentnych przez toksyczne metabolity i ewentualnie krążące kompleksy immunologiczne.
Jak wykazały badania, u chorych z ciężkimi postaciami zapalenia wątroby typu B, zwłaszcza w przypadku rozwoju masywnej martwicy wątroby, miano HBsAg i HBeAg w surowicy krwi ulega obniżeniu, a jednocześnie zaczynają być wykrywane wysokie miana przeciwciał przeciwko antygenowi powierzchniowemu, co jest zupełnie nietypowe dla łagodnych postaci choroby, w których przeciwciała anty-HBV pojawiają się dopiero w 3.-5. miesiącu choroby.
Szybkie zanikanie antygenów wirusa zapalenia wątroby typu B przy jednoczesnym pojawieniu się wysokich mian przeciwciał przeciwwirusowych wskazuje na intensywne tworzenie się kompleksów immunologicznych i ich możliwy udział w patogenezie rozwoju masywnej martwicy wątroby.
Tak więc materiały faktograficzne nie pozwalają nam jednoznacznie interpretować zapalenia wątroby typu B tylko z punktu widzenia agresji immunopatologicznej. I nie chodzi tylko o to, że nie ma związku między głębokością i częstością występowania zmian morfologicznych w wątrobie z jednej strony, a nasileniem czynników odporności komórkowej z drugiej. Teoretycznie okoliczność tę można by wyjaśnić późnymi etapami badania wskaźników odporności komórkowej, kiedy komórki immunokompetentne były poddawane silnym toksycznym efektom z powodu narastającej niewydolności czynnościowej wątroby. Oczywiście można założyć, że immunocytolizę hepatocytów obserwuje się na najwcześniejszych etapach procesu zakaźnego, być może nawet przed pojawieniem się objawów klinicznych poważnego uszkodzenia wątroby. Jednakże takie przypuszczenie jest mało prawdopodobne, gdyż podobne wskaźniki odporności komórkowej wykryto u chorych z najostrzejszym (błyskawicznym) przebiegiem choroby, a ponadto podczas badania morfologicznego tkanki wątroby nie wykryto masywnego nacieku limfocytarnego, podczas gdy jednocześnie wykryto ciągłe pola martwiczego nabłonka bez zjawisk resorpcji i agresji limfocytarnej.
Bardzo trudno jest wyjaśnić obraz morfologiczny ostrego zapalenia wątroby wyłącznie z punktu widzenia cytolizy komórek układu odpornościowego, dlatego też we wczesnych badaniach nie wykluczono cytotoksycznego działania wirusa zapalenia wątroby typu B.
Obecnie przypuszczenie to zostało częściowo potwierdzone odkryciem wirusa zapalenia wątroby typu B. Jak wykazały badania, częstość wykrywania markerów zapalenia wątroby typu D jest bezpośrednio zależna od ciężkości choroby: w postaci łagodnej wykrywa się je u 14%, umiarkowanej u 18%, ciężkiej u 30%, a złośliwej u 52% pacjentów. Biorąc pod uwagę, że wirus zapalenia wątroby typu D ma nekrogenne działanie cytopatyczne, można uznać, że koinfekcja wirusami zapalenia wątroby typu B i D ma duże znaczenie w rozwoju piorunujących postaci zapalenia wątroby typu B.
Patogenezę zapalenia wątroby typu B można przedstawić następująco. Po wniknięciu wirusa zapalenia wątroby typu B do hepatocytów, atak immunologiczny na zakażone hepatocyty jest indukowany przez T-killery, które wydzielają limfotoksyny w kierunku komórek wątroby.
Intymne mechanizmy uszkodzenia hepatocytów w zapaleniu wątroby typu B nie zostały jeszcze ustalone. Wiodącą rolę odgrywają aktywowane procesy peroksydacji lipidów i hydrolazy lizosomalne. Wyzwalaczem mogą być limfotoksyny uwalniane z komórek efektorowych po ich kontakcie z hepatocytami, ale możliwe jest, że sam wirus może być inicjatorem procesów peroksydacji. Następnie proces patologiczny najprawdopodobniej rozwija się w następującej kolejności.
- Interakcja czynnika agresji (limfotoksyny lub wirusa) z makrocząsteczkami biologicznymi (prawdopodobnie ze składnikami błon siateczki śródplazmatycznej zdolnymi do uczestniczenia w procesach detoksykacji, analogicznie do innych czynników uszkadzających, co wykazano w odniesieniu do czterochlorku węgla).
- Powstawanie wolnych rodników, aktywacja procesów peroksydacji lipidów i zwiększona przepuszczalność wszystkich błon hepatocytarnych (zespół cytolizy).
- Przemieszczanie się substancji biologicznie czynnych wzdłuż gradientu stężeń – utrata enzymów o różnych lokalizacjach wewnątrzkomórkowych, donorów energii, potasu itp. Gromadzenie się sodu i wapnia w komórkach, przesunięcie pH w kierunku kwasicy wewnątrzkomórkowej.
- Aktywacja i uwolnienie hydrolaz lizosomalnych (RNAzy, DNAzy, katepsyn itp.) powodujące rozpad komórek wątroby i uwolnienie autoantygenów.
- Stymulacja układu odpornościowego T i B z wytworzeniem swoistej sensytyzacji limfocytów T na lipoproteiny wątrobowe, a także wytworzeniem przeciwwątrobowych przeciwciał humoralnych.
W proponowanym schemacie patogenezy zapalenia wątroby typu B czynnikiem wyzwalającym są antygeny wirusowe, których intensywną produkcję obserwuje się we wczesnych stadiach choroby i przez cały okres ostry, z wyjątkiem postaci złośliwych, w których produkcja antygenów wirusowych praktycznie ustaje w momencie rozwoju masywnej martwicy wątroby, co z góry warunkuje szybki spadek replikacji wirusa.
Oczywiste jest również, że antygeny wirusowe aktywują układy odporności T i B. Podczas tego procesu następuje charakterystyczna redystrybucja subpopulacji limfocytów T, której celem jest zorganizowanie odpowiedniej odpowiedzi immunologicznej, wyeliminowanie zakażonych hepatocytów, neutralizacja antygenów wirusowych, sanogeneza i wyzdrowienie.
Kiedy komórki immunokompetentne wchodzą w interakcję z antygenami wirusowymi na błonach hepatocytów lub w trakcie namnażania się wirusa wewnątrz hepatocytu, powstają warunki do aktywacji procesów peroksydacji lipidów, które, jak wiadomo, kontrolują przepuszczalność wszystkich błon komórkowych i subkomórkowych.
Z tego punktu widzenia zrozumiałe staje się występowanie zespołu cytolizy, czyli zwiększonej przepuszczalności błon komórkowych, która jest tak naturalna i charakterystyczna dla wirusowego zapalenia wątroby.
Końcowym efektem zespołu cytolizy może być całkowite odłączenie fosforylacji oksydacyjnej, wyciek materiału komórkowego i śmierć miąższu wątroby.
Jednakże w zdecydowanej większości przypadków procesy te nie nabierają aż tak fatalnego rozwoju. Tylko w złośliwych formach choroby proces patologiczny przebiega lawinowo i nieodwracalnie, gdyż dochodzi do masywnego zakażenia, wyraźnego procesu immunologicznego, nadmiernej aktywacji procesów peroksydacji i hydrodaz lizosomalnych oraz zjawisk agresji autoimmunologicznej.
Te same mechanizmy obserwuje się w korzystnym przebiegu zapalenia wątroby typu B, z tą tylko osobliwością, że wszystkie są realizowane na jakościowo różnym poziomie. W przeciwieństwie do przypadków masywnej martwicy wątroby, w korzystnym przebiegu choroby liczba zakażonych hepatocytów, a zatem strefa immunopatologicznej cytolizy jest mniejsza, procesy peroksydacji lipidów nie są tak znacząco nasilone, aktywacja kwaśnych hydrolaz prowadzi jedynie do ograniczonej autolizy z nieznacznym uwalnianiem autoantygenów, a zatem bez masywnej autoagresji, czyli wszystkie etapy patogenezy w korzystnym przebiegu są przeprowadzane w ramach zachowanej organizacji strukturalnej miąższu wątroby i są hamowane przez systemy obronne (przeciwutleniacze, inhibitory itp.), a zatem nie mają tak destrukcyjnego wpływu.
Przyczyny objawów intoksykacji w wirusowym zapaleniu wątroby nie zostały w pełni zbadane. Propozycja rozróżnienia tzw. zatrucia pierwotnego, czyli wirusowego, od wtórnego (wymiennego, czyli metabolicznego) może być uznana za pozytywną, chociaż nie ujawnia ona intymnego mechanizmu występowania ogólnego zespołu toksycznego. Po pierwsze, wirusy zapalenia wątroby nie mają właściwości toksycznych, a po drugie, stężenie wielu metabolitów nie zawsze koreluje z ciężkością choroby i stopniem ekspresji objawów toksykozy. Wiadomo również, że stężenie antygenów wirusowych nie koreluje ściśle z ciężkością zatrucia. Przeciwnie, wraz ze wzrostem ciężkości choroby, a zatem wzrostem stopnia toksykozy, stężenie HBsAg spada i jest najniższe w postaciach złośliwych w momencie wystąpienia głębokiej śpiączki wątrobowej. Jednocześnie częstość wykrywania i miana swoistych przeciwciał przeciwwirusowych zależą bezpośrednio od ciężkości choroby.
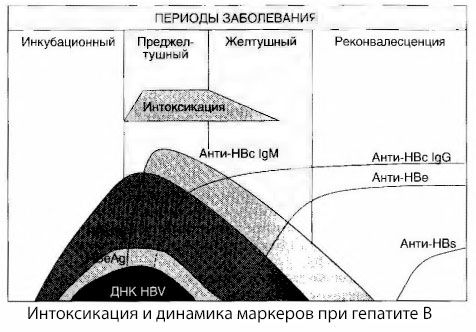
Zatrucie pojawia się nie w momencie rejestracji antygenów wirusowych, ale w okresie krążenia we krwi przeciwciał przeciwwirusowych klasy IgM do antygenu krowiego i antygenu układu E. Co więcej, w ciężkich i szczególnie złośliwych postaciach znaczna część pacjentów ma nawet przeciwciała anty-HBs we krwi, czego zwykle nigdy nie obserwuje się w łagodnych i umiarkowanych postaciach choroby.
Przedstawione dane pozwalają na wyciągnięcie wniosku, że zespół toksykozy w wirusowym zapaleniu wątroby, a w szczególności w zapaleniu wątroby typu B, nie powstaje w wyniku pojawienia się antygenów wirusowych we krwi, ale jest konsekwencją interakcji antygenów wirusowych z przeciwciałami przeciwwirusowymi klasy IgM. Skutkiem takiej interakcji, jak wiadomo, jest powstawanie kompleksów immunologicznych i ewentualnie aktywnych substancji toksycznych.
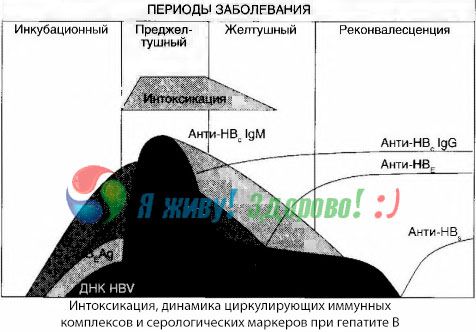
Objawy zatrucia pojawiają się w momencie pojawienia się kompleksów immunologicznych w wolnym krążeniu, lecz później takiej zależności nie obserwuje się.
Częściowe wyjaśnienie tego zjawiska można znaleźć w badaniu składu kompleksów immunologicznych. U pacjentów z ciężkimi postaciami we krwi krążą głównie kompleksy średniej wielkości, a w ich składzie, w szczytowym okresie zespołu toksycznego, dominują przeciwciała klasy IgG, natomiast w okresie spadku objawów klinicznych i rekonwalescencji kompleksy stają się większe, a w ich składzie zaczynają dominować przeciwciała klasy IgG.
Przedstawione dane dotyczą mechanizmów rozwoju zespołu toksycznego w początkowym okresie choroby, ale w zatruciach występujących w szczytowym okresie objawów klinicznych mają one tylko częściowe znaczenie, zwłaszcza w rozwoju śpiączki wątrobowej.
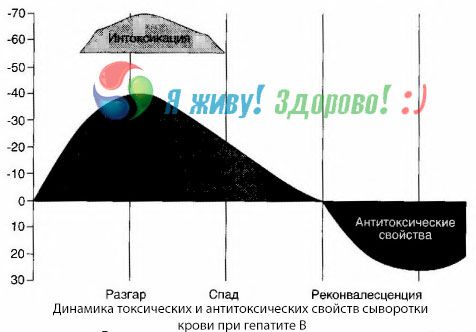
Metoda posiewów krwi wykazała, że w przypadku zapalenia wątroby typu B toksyny stale gromadzą się we krwi, uwalniane z uszkodzonej, rozkładającej się tkanki wątroby. Stężenie tych toksyn jest proporcjonalne do ciężkości choroby, mają one charakter białkowy.
W okresie rekonwalescencji we krwi pojawiają się przeciwciała przeciwko tej toksynie; natomiast w przypadku śpiączki wątrobowej stężenie toksyny we krwi gwałtownie wzrasta, a przeciwciał nie wykrywa się we krwi.
Patomorfologia zapalenia wątroby typu B
Ze względu na charakter zmian morfologicznych wyróżnia się trzy postacie ostrego zapalenia wątroby typu B:
- forma cykliczna,
- masywna martwica wątroby;
- cholestatyczne pericholangiolityczne zapalenie wątroby.
W cyklicznej postaci zapalenia wątroby typu B zmiany dystroficzne, zapalne i proliferacyjne są bardziej widoczne w centrum zrazików, podczas gdy w zapaleniu wątroby typu A są zlokalizowane wzdłuż obwodu zrazika, rozprzestrzeniając się do środka. Różnice te tłumaczy się różnymi drogami wnikania wirusa do miąższu wątroby. Wirus zapalenia wątroby typu A wnika do wątroby przez żyłę wrotną i rozprzestrzenia się do środka zrazików, wirus zapalenia wątroby typu B wnika przez tętnicę wątrobową i gałęzie naczyń włosowatych, które równomiernie zaopatrują wszystkie zraziki, aż do ich środka.
Stopień uszkodzenia miąższu wątroby w większości przypadków odpowiada ciężkości objawów klinicznych choroby. W łagodnych postaciach obserwuje się zazwyczaj martwicę ogniskową hepatocytów, a w umiarkowanych i ciężkich martwicę strefową (z tendencją do zlewania się i tworzenia martwicy mostkowej w ciężkich postaciach choroby).
Największe zmiany morfologiczne w miąższu wątroby obserwuje się w szczytowym momencie objawów klinicznych, który zwykle pokrywa się z pierwszą dekadą choroby. W drugiej, a zwłaszcza trzeciej dekadzie nasila się proces regeneracji. W tym okresie zmiany nekrobiotyczne prawie całkowicie zanikają, a zaczynają dominować procesy naciekania komórkowego z powolną, następczą odbudową struktury płytek wątrobowokomórkowych. Jednak całkowite przywrócenie struktury i funkcji miąższu wątroby następuje dopiero po 3-6 miesiącach od wystąpienia choroby i nie u wszystkich pacjentów.
Uogólniony charakter zakażenia wirusem zapalenia wątroby typu B potwierdza wykrycie antygenu HBs nie tylko w hepatocytach, ale także w nerkach, płucach, śledzionie, trzustce, komórkach szpiku kostnego itp.
Zapalenie wątroby cholestatyczne (pericholangiolityczne) jest szczególną postacią choroby, w której największe zmiany morfologiczne występują na części wewnątrzwątrobowych dróg żółciowych, z obrazem cholangiolitis i pericholangiolitis. W postaci cholestatycznej cholestaza występuje z rozszerzeniem naczyń włosowatych żółciowych z zastojem żółci w nich, z proliferacją cholangioli i nacieków komórkowych wokół nich. Komórki wątroby są w tej postaci zapalenia wątroby dotknięte w niewielkim stopniu. Klinicznie choroba charakteryzuje się przewlekłym przebiegiem z przedłużającą się żółtaczką. Wykazano, że przyczyną tak osobliwego przebiegu choroby jest dominujący wpływ wirusa na ściany cholangioli z nieznacznym wpływem na hepatocyty.

