Ekspert medyczny artykułu
Nowe publikacje
Synteza, wydzielanie i metabolizm katecholamin
Ostatnia recenzja: 06.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
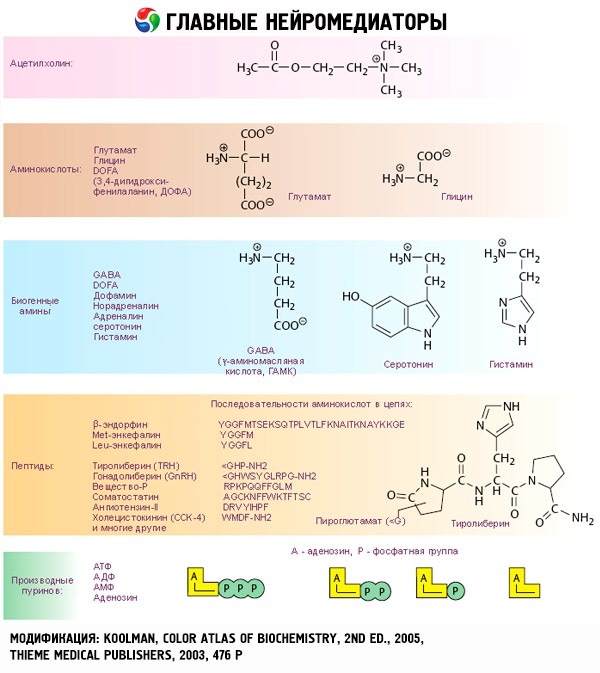
Rdzeń nadnerczy wytwarza związki o strukturze dalekiej od steroidów. Zawierają jądro 3,4-dihydroksyfenylu (katecholu) i są nazywane katecholaminami. Należą do nich adrenalina, noradrenalina i dopamina beta-hydroksytyramina.
Kolejność syntezy katecholamin jest dość prosta: tyrozyna → dihydroksyfenyloalanina (DOPA) → dopamina → noradrenalina → adrenalina. Tyrozyna dostaje się do organizmu z pożywieniem, ale może być również wytwarzana z fenyloalaniny w wątrobie pod wpływem hydroksylazy fenyloalaniny. Produkty końcowe przemiany tyrozyny w tkankach są różne. W rdzeniu nadnerczy proces ten przechodzi do etapu powstawania adrenaliny, w zakończeniach nerwów współczulnych - noradrenaliny, w niektórych neuronach ośrodkowego układu nerwowego synteza katecholamin kończy się powstaniem dopaminy.
Konwersja tyrozyny do DOPA jest katalizowana przez hydroksylazę tyrozynową, której kofaktorami są tetrahydrobiopteryna i tlen. Uważa się, że enzym ten ogranicza szybkość całego procesu biosyntezy katecholamin i jest hamowany przez produkty końcowe procesu. Hydroksylaza tyrozynowa jest głównym celem działań regulacyjnych na biosyntezę katecholamin.
Konwersję DOPA do dopaminy katalizuje enzym DOPA dekarboksylaza (kofaktor - fosforan pirydoksalu), który jest stosunkowo niespecyficzny i dekarboksyluje inne aromatyczne L-aminokwasy. Istnieją jednak przesłanki wskazujące na możliwość modyfikacji syntezy katecholamin poprzez zmianę aktywności tego enzymu. Niektóre neurony nie mają enzymów do dalszej konwersji dopaminy, a jest ona produktem końcowym. Inne tkanki zawierają beta-hydroksylazę dopaminową (kofaktory - miedź, kwas askorbinowy i tlen), która przekształca dopaminę w noradrenalinę. W rdzeniu nadnerczy (ale nie w zakończeniach nerwów współczulnych) występuje fenyloetanoloamina - metylotransferaza, która tworzy adrenalinę z noradrenaliny. W tym przypadku S-adenozylometionina służy jako donor grup metylowych.
Ważne jest, aby pamiętać, że synteza fenyloetanoloamino-N-metylotransferazy jest indukowana przez glikokortykoidy wchodzące do rdzenia z kory przez układ żyły wrotnej. Może to wyjaśniać fakt, że dwa różne gruczoły dokrewne są połączone w jednym narządzie. Znaczenie glikokortykoidów dla syntezy adrenaliny podkreśla fakt, że komórki rdzenia nadnerczy, które produkują noradrenalinę, znajdują się wokół naczyń tętniczych, podczas gdy komórki produkujące adrenalinę otrzymują krew głównie z zatok żylnych zlokalizowanych w korze nadnerczy.
Rozpad katecholamin zachodzi głównie pod wpływem dwóch układów enzymatycznych: katecholo-O-metylotransferazy (COMT) i monoaminooksydazy (MAO). Główne szlaki rozpadu adrenaliny i noradrenaliny przedstawiono schematycznie na ryc. 54. Pod wpływem COMT w obecności donora grupy metylowej S-adrenozylometioniny, katecholaminy przekształcają się w normetanefrynę i metanefrynę (3-O-metylowe pochodne noradrenaliny i adrenaliny), które pod wpływem MAO przekształcają się w aldehydy, a następnie (w obecności aldehydooksydazy) w kwas wanilinomigdałowy (VMA), główny produkt rozpadu noradrenaliny i adrenaliny. W tym samym przypadku, gdy katecholaminy są początkowo wystawione na działanie MAO, a nie COMT, są przekształcane w 3,4-dioksomandelowy aldehyd, a następnie pod wpływem oksydazy aldehydowej i COMT w kwas 3,4-dioksomandelowy i VMC. W obecności dehydrogenazy alkoholowej, 3-metoksy-4-oksyfenyloglikol, który jest głównym produktem końcowym degradacji adrenaliny i noradrenaliny w ośrodkowym układzie nerwowym, może być utworzony z katecholamin.
Rozpad dopaminy przebiega podobnie, z tą różnicą, że jej metabolity nie posiadają grupy hydroksylowej przy atomie węgla beta i dlatego zamiast kwasu wanilinomigdałowego powstaje kwas homowanilinowy (HVA) lub kwas 3-metoksy-4-hydroksyfenylooctowy.

Zakłada się również istnienie szlaku chinoidowego utleniania cząsteczki katecholaminy, który może prowadzić do powstania produktów pośrednich o wyraźnej aktywności biologicznej.
Noradrenalina i adrenalina powstające pod wpływem enzymów cytozolowych w zakończeniach nerwów współczulnych i rdzeniu nadnerczy przedostają się do granulek wydzielniczych, co chroni je przed działaniem enzymów degradacyjnych. Wychwytywanie katecholamin przez granulki wymaga wydatku energetycznego. W granulkach chromochłonnych rdzenia nadnerczy katecholaminy są ściśle związane z ATP (w stosunku 4:1) i specyficznymi białkami - chromograninami, co zapobiega dyfuzji hormonów z granulek do cytoplazmy.
Bezpośrednim bodźcem do wydzielania katecholamin jest najwyraźniej wnikanie wapnia do komórki, stymulujące egzocytozę (zlanie się błony ziarnistej z powierzchnią komórki i jej pęknięcie z całkowitym uwolnieniem rozpuszczalnej zawartości – katecholamin, beta-hydroksylazy dopaminy, ATP i chromogranin – do płynu pozakomórkowego).
Fizjologiczne działanie katecholamin i mechanizm ich działania
Efekty katecholamin zaczynają się od interakcji ze specyficznymi receptorami komórek docelowych. Podczas gdy receptory hormonów tarczycy i steroidowych są zlokalizowane wewnątrz komórek, receptory katecholamin (a także acetylocholiny i hormonów peptydowych) są obecne na zewnętrznej powierzchni komórki.
Od dawna ustalono, że w odniesieniu do niektórych reakcji adrenalina lub noradrenalina są skuteczniejsze niż syntetyczna katecholamina izoproterenol, podczas gdy w odniesieniu do innych działanie izoproterenolu jest lepsze od działania adrenaliny lub noradrenaliny. Na tej podstawie opracowano koncepcję obecności w tkankach dwóch typów adrenoreceptorów: alfa i beta, a w niektórych z nich może występować tylko jeden z tych dwóch typów. Izoproterenol jest najsilniejszym agonistą beta-adrenoreceptorów, podczas gdy syntetyczny związek fenylefryna jest najsilniejszym agonistą alfa-adrenoreceptorów. Naturalne katecholaminy - adrenalina i noradrenalina - są w stanie oddziaływać z receptorami obu typów, ale adrenalina wykazuje większe powinowactwo do beta-, a noradrenalina - do alfa-receptorów.
Katecholaminy aktywują receptory beta-adrenergiczne serca silniej niż receptory beta mięśni gładkich, co pozwoliło na podział typu beta na podtypy: receptory beta1 (serce, komórki tłuszczowe) i receptory beta2 (oskrzela, naczynia krwionośne itp.). Działanie izoproterenolu na receptory beta1 przewyższa działanie adrenaliny i noradrenaliny tylko 10-krotnie, podczas gdy na receptory beta2 działa 100-1000 razy silniej niż naturalne katecholaminy.
Zastosowanie specyficznych antagonistów (fentolaminy i fenoksybenzaminy dla alfa- i propranololu dla beta-receptorów) potwierdziło adekwatność klasyfikacji adrenoreceptorów. Dopamina jest zdolna do interakcji zarówno z alfa-, jak i beta-receptorami, ale różne tkanki (mózg, przysadka mózgowa, naczynia) mają również własne receptory dopaminergiczne, których specyficznym blokerem jest haloperidol. Liczba beta-receptorów waha się od 1000 do 2000 na komórkę. Biologiczne efekty katecholamin pośredniczone przez beta-receptory są zwykle związane z aktywacją cyklazy adenylanowej i wzrostem wewnątrzkomórkowej zawartości cAMP. Chociaż receptor i enzym są funkcjonalnie połączone, są różnymi makrocząsteczkami. Trifosforan guanozyny (GTP) i inne nukleotydy purynowe uczestniczą w modulacji aktywności cyklazy adenylanowej pod wpływem kompleksu hormon-receptor. Zwiększając aktywność enzymów, wydają się one zmniejszać powinowactwo receptorów beta do agonistów.
Zjawisko zwiększonej wrażliwości struktur odnerwionych jest znane od dawna. Natomiast przedłużona ekspozycja na agonisty zmniejsza wrażliwość tkanek docelowych. Badanie receptorów beta umożliwiło wyjaśnienie tych zjawisk. Wykazano, że przedłużona ekspozycja na izoproterenol prowadzi do utraty wrażliwości cyklazy adenylanowej z powodu zmniejszenia liczby receptorów beta.
Proces desensytyzacji nie wymaga aktywacji syntezy białek i prawdopodobnie jest spowodowany stopniowym tworzeniem nieodwracalnych kompleksów hormon-receptor. Przeciwnie, wprowadzenie 6-oksydoaminy, która niszczy zakończenia współczulne, wiąże się ze wzrostem liczby reagujących beta-receptorów w tkankach. Możliwe, że wzrost aktywności układu współczulnego powoduje również związaną z wiekiem desensytyzację naczyń krwionośnych i tkanki tłuszczowej w odniesieniu do katecholamin.
Liczbę adrenoreceptorów w różnych narządach mogą kontrolować inne hormony. Tak więc estradiol zwiększa, a progesteron zmniejsza liczbę alfa-adrenoreceptorów w macicy, czemu towarzyszy odpowiedni wzrost i spadek jej odpowiedzi skurczowej na katecholaminy. Jeśli wewnątrzkomórkowym „drugim przekaźnikiem” utworzonym przez działanie agonistów beta-receptorów jest z pewnością cAMP, to sytuacja w odniesieniu do przekaźnika efektów alfa-adrenergicznych jest bardziej skomplikowana. Zakłada się istnienie różnych mechanizmów: spadek poziomu cAMP, wzrost zawartości cAMP, modulację dynamiki wapnia komórkowego itp.
Aby odtworzyć różne efekty w organizmie, zwykle wymagane są dawki adrenaliny 5-10 razy mniejsze niż noradrenalina. Chociaż ta ostatnia jest skuteczniejsza w stosunku do receptorów a- i beta1-adrenergicznych, ważne jest, aby pamiętać, że obie endogenne katecholaminy są zdolne do interakcji zarówno z receptorami alfa, jak i beta. Dlatego odpowiedź biologiczna danego narządu na aktywację adrenergiczną w dużej mierze zależy od rodzaju obecnych w nim receptorów. Nie oznacza to jednak, że selektywna aktywacja połączenia nerwowego lub humoralnego układu współczulno-nadnerczowego jest niemożliwa. W większości przypadków obserwuje się zwiększoną aktywność jego różnych połączeń. Tak więc powszechnie przyjmuje się, że hipoglikemia odruchowo aktywuje rdzeń nadnerczy, podczas gdy spadkowi ciśnienia krwi (niedociśnieniu ortostatycznym) towarzyszy głównie uwalnianie noradrenaliny z zakończeń nerwów współczulnych.
Adrenoreceptory i skutki ich aktywacji w różnych tkankach
Układ, narząd |
Typ receptora adrenergicznego |
Reakcja |
Układ sercowo-naczyniowy: |
||
Serce |
Beta |
Zwiększona częstość akcji serca, przewodnictwo i kurczliwość |
Tętniczki: |
||
Skóra i błony śluzowe |
Alfa |
Zmniejszenie |
Mięśnie szkieletowe |
Beta |
Rozszerzenie i skurczenie |
Narządy jamy brzusznej |
Alfa (więcej) |
Zmniejszenie |
Beta |
Rozszerzenie |
|
Słojowanie |
Alfa |
Zmniejszenie |
Układ oddechowy: |
||
Mięśnie oskrzeli |
Beta |
Rozszerzenie |
Układ trawienny: |
||
Żołądek |
Beta |
Osłabione zdolności motoryczne |
Jelita |
Alfa |
Skurcz zwieraczy |
Śledziona |
Alfa |
Zmniejszenie |
Beta |
Relaks |
|
Trzustka zewnątrzwydzielnicza |
Alfa |
Zmniejszone wydzielanie |
Układ moczowo-płciowy: |
Alfa |
Skurcz zwieracza |
Pęcherz moczowy |
Beta |
Rozluźnienie mięśnia wyrzutowego |
Narządy płciowe męskie |
Alfa |
Wytrysk |
Oczy |
Alfa |
Rozszerzenie źrenicy |
Skóra |
Alfa |
Zwiększone pocenie |
Ślinianki |
Alfa |
Wydalanie potasu i wody |
Beta |
Wydzielanie amylazy |
|
Gruczoły dokrewne: |
||
Wyspy trzustkowe |
||
Komórki beta |
Alfa (więcej) |
Zmniejszone wydzielanie insuliny |
Beta |
Zwiększone wydzielanie insuliny |
|
Komórki alfa |
Beta |
Zwiększone wydzielanie glukagonu |
8-komórkowy |
Beta |
Zwiększone wydzielanie somatostatyny |
Podwzgórze i przysadka mózgowa: |
||
Somatotrofy |
Alfa |
Zwiększone wydzielanie STH |
Beta |
Zmniejszone wydzielanie STH |
|
Laktotrofy |
Alfa |
Zmniejszone wydzielanie prolaktyny |
Tyreotrofy |
Alfa |
Zmniejszone wydzielanie TSH |
Kortykotrofy |
Alfa |
Zwiększone wydzielanie ACTH |
| beta | Zmniejszone wydzielanie ACTH | |
Tarczyca: |
||
Komórki pęcherzykowe |
Alfa |
Zmniejszone wydzielanie tyroksyny |
Beta |
Zwiększone wydzielanie tyroksyny |
|
Komórki parafolikularne (K) |
Beta |
Zwiększone wydzielanie kalcytoniny |
Przytarczyce |
Beta |
Zwiększone wydzielanie PTH |
Nerki |
Beta |
Zwiększone wydzielanie reniny |
Żołądek |
Beta |
Zwiększone wydzielanie gastryny |
BX |
Beta |
Zwiększone zużycie tlenu |
Wątroba |
? |
Zwiększona glikogenoliza i glukoneogeneza wraz z uwolnieniem glukozy; zwiększona ketogeneza wraz z uwolnieniem ciał ketonowych |
Tkanka tłuszczowa |
Beta |
Zwiększona lipoliza z uwolnieniem wolnych kwasów tłuszczowych i glicerolu |
Mięśnie szkieletowe |
Beta |
Zwiększona glikoliza z uwalnianiem pirogronianu i mleczanu; zmniejszona proteoliza ze zmniejszeniem uwalniania alaniny i glutaminy |
Ważne jest, aby wziąć pod uwagę, że wyniki dożylnego podawania katecholamin nie zawsze adekwatnie odzwierciedlają działanie związków endogennych. Dotyczy to głównie noradrenaliny, ponieważ w organizmie uwalnia się ona głównie nie do krwi, ale bezpośrednio do szczelin synaptycznych. Dlatego endogenna noradrenalina aktywuje na przykład nie tylko naczyniowe receptory alfa (wzrost ciśnienia krwi), ale także receptory beta serca (przyspieszenie akcji serca), podczas gdy wprowadzenie noradrenaliny z zewnątrz prowadzi głównie do aktywacji naczyniowych receptorów alfa i odruchowego (poprzez nerw błędny) spowolnienia akcji serca.
Niskie dawki adrenaliny aktywują głównie receptory beta naczyń mięśniowych i serca, co powoduje zmniejszenie obwodowego oporu naczyniowego i zwiększenie rzutu serca. W niektórych przypadkach może przeważać pierwszy efekt, a po podaniu adrenaliny rozwija się niedociśnienie. W wyższych dawkach adrenalina aktywuje również receptory alfa, czemu towarzyszy wzrost obwodowego oporu naczyniowego i na tle wzrostu rzutu serca prowadzi do wzrostu ciśnienia tętniczego. Jednak jej wpływ na naczyniowe receptory beta jest również zachowany. W rezultacie wzrost ciśnienia skurczowego przekracza podobny wskaźnik ciśnienia rozkurczowego (wzrost ciśnienia tętna). Wraz z wprowadzeniem jeszcze wyższych dawek zaczynają przeważać alfa-mimetyczne efekty adrenaliny: ciśnienie skurczowe i rozkurczowe wzrastają równolegle, jak pod wpływem noradrenaliny.
Wpływ katecholamin na metabolizm składa się z ich bezpośredniego i pośredniego wpływu. Pierwsze realizowane są głównie poprzez receptory beta. Bardziej złożone procesy są związane z wątrobą. Chociaż tradycyjnie uważa się, że zwiększona glikogenoliza wątrobowa jest wynikiem aktywacji receptora beta, istnieją również dowody na udział receptora alfa. Pośrednie efekty katecholamin są związane z modulacją wydzielania wielu innych hormonów, takich jak insulina. W wpływie adrenaliny na jej wydzielanie wyraźnie dominuje składnik alfa-adrenergiczny, ponieważ wykazano, że każdemu stresowi towarzyszy zahamowanie wydzielania insuliny.
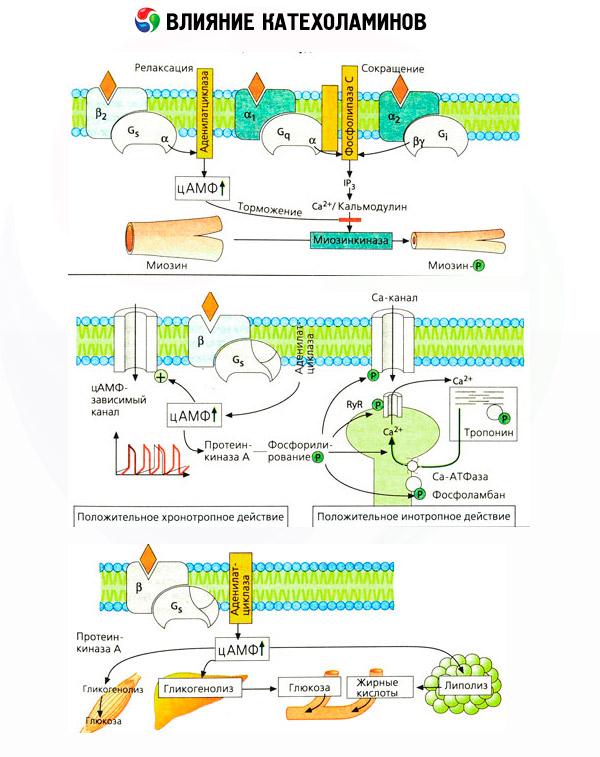
Połączenie bezpośredniego i pośredniego działania katecholamin powoduje hiperglikemię, związaną nie tylko ze zwiększoną produkcją glukozy w wątrobie, ale także z zahamowaniem jej wykorzystania przez tkanki obwodowe. Przyspieszenie lipolizy powoduje hiperlipacydemię ze zwiększonym dostarczaniem kwasów tłuszczowych do wątroby i nasileniem produkcji ciał ketonowych. Zwiększona glikoliza w mięśniach prowadzi do zwiększenia uwalniania mleczanu i pirogronianu do krwi, które wraz z glicerolem uwalnianym z tkanki tłuszczowej służą jako prekursory glukoneogenezy wątrobowej.
Regulacja wydzielania katecholamin. Podobieństwo produktów i sposobów reakcji układu współczulnego i rdzenia nadnerczy stanowiło podstawę połączenia tych struktur w jeden układ współczulno-nadnerczowy organizmu z rozmieszczeniem jego połączeń nerwowych i hormonalnych. Różne sygnały aferentne koncentrują się w podwzgórzu i ośrodkach rdzenia kręgowego i rdzenia przedłużonego, skąd pochodzą sygnały eferentne, przechodzące do ciał komórkowych neuronów przedzwojowych zlokalizowanych w rogach bocznych rdzenia kręgowego na poziomie segmentów VIII szyjnego – II-III lędźwiowego.
Aksony przedzwojowe tych komórek opuszczają rdzeń kręgowy i tworzą połączenia synaptyczne z neuronami zlokalizowanymi w zwojach łańcucha współczulnego lub z komórkami rdzenia nadnerczy. Te włókna przedzwojowe są cholinergiczne. Pierwsza zasadnicza różnica między współczulnymi neuronami postganglionowymi a komórkami chromochłonnymi rdzenia nadnerczy polega na tym, że te ostatnie przekazują sygnał cholinergiczny otrzymany przez nie nie poprzez przewodzenie nerwowe (nerwy postganglionowe adrenergiczne), ale poprzez szlak humoralny, uwalniając związki adrenergiczne do krwi. Druga różnica polega na tym, że nerwy postganglionowe wytwarzają noradrenalinę, podczas gdy komórki rdzenia nadnerczy wytwarzają głównie adrenalinę. Te dwie substancje mają różny wpływ na tkanki.

