Ekspert medyczny artykułu
Nowe publikacje
Leki
Dopamina
Ostatnia recenzja: 03.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Dopamina (DA) jest obwodowym lekiem rozszerzającym naczynia krwionośne, stosowanym w leczeniu niskiego ciśnienia krwi, niskiego tętna i zatrzymania akcji serca, szczególnie w ostrych warunkach noworodkowych, poprzez ciągły wlew dożylny. [ 1 ] Niskie szybkości infuzji (0,5 do 2 mcg/kg na minutę) działają na naczynia krwionośne trzewne, powodując rozszerzenie naczyń, w tym nerek, co skutkuje zwiększonym wydalaniem moczu. Średnie szybkości infuzji (2 do 10 mcg/kg/min) stymulują kurczliwość mięśnia sercowego i zwiększają przewodzenie elektryczne w sercu, co skutkuje zwiększonym rzutem serca. Wyższe dawki powodują zwężenie naczyń krwionośnych i wzrost ciśnienia krwi za pośrednictwem receptorów adrenergicznych alfa-1, beta-1 i beta-2, co potencjalnie prowadzi do zapaści krążenia obwodowego. [ 2 ]
Wskazania Dopamina
Wskazania do stosowania dopaminy obejmują utrzymanie ciśnienia krwi w przewlekłej niewydolności serca, urazie, niewydolności nerek, a nawet operacji na otwartym sercu i wstrząsie spowodowanym zawałem mięśnia sercowego lub posocznicą. Podawanie małych dawek dopaminy może być również przydatne w leczeniu niedociśnienia, niskiego rzutu serca i niewydolności narządów (często wskazywanej przez niskie wydalanie moczu). DA nabrała istotnego znaczenia klinicznego w ośrodkowym układzie nerwowym (OUN) po tym, jak eksperymenty Horniewicza wykazały jej redukcję w jądrze ogoniastym u pacjentów z chorobą Parkinsona. Ponadto dożylne podanie jej prekursora aminokwasowego, L-DOPA (L-dihydroksyfenyloalaniny), łagodzi objawy parkinsonizmu. [ 3 ] Ponieważ bariera krew-mózg uniemożliwia DA przedostanie się do OUN z krążenia ogólnoustrojowego, DA jest nieskuteczna w ośrodkowych zaburzeniach neurologicznych, takich jak choroba Parkinsona. Jednak L-DOPA skutecznie przekracza barierę krew-mózg i może być podawana ogólnoustrojowo, w tym w postaci tabletek doustnych. Chociaż terapeutyczna terapia zastępcza dopaminą jest skuteczna w łagodzeniu objawów motorycznych, może powodować działania niepożądane w zakresie motoryki i problemy behawioralne związane z uzależnieniem (np. zaburzenia kontroli impulsów) [ 4 ], [ 5 ], [ 6 ]
Formularz zwolnienia
Dopamina dostępna jest w ampułkach jako koncentrat do sporządzania roztworu do infuzji.
Farmakodynamika
Biosynteza dopaminy przebiega według tej samej sekwencji enzymatycznej co noradrenalina (NE). W rzeczywistości DA jest prekursorem syntezy NE (patrz rysunek). [ 7 ], [ 8 ] Pierwszy etap syntezy DA ogranicza szybkość i obejmuje konwersję L-tyrozyny do L-DOPA przez enzym hydroksylazę tyrozynową (TH). [ 9 ], [ 10 ] Ta konwersja wymaga tlenu, kofaktora żelaza i tetrahydrobiopteryny (BH4 lub THB) i skutkuje dodaniem grupy hydroksylowej do pierścienia aromatycznego w celu utworzenia L-DOPA. Ta cząsteczka jest następnie przekształcana w DA przez aromatyczną dekarboksylazę L-aminokwasów z usunięciem grupy karboksylowej. Po syntezie DA jest transportowana do pęcherzyków synaptycznych za pośrednictwem pęcherzykowego transportera monoamin 2 (VMAT2) do zakończeń synaptycznych. [ 11 ], [ 12 ]
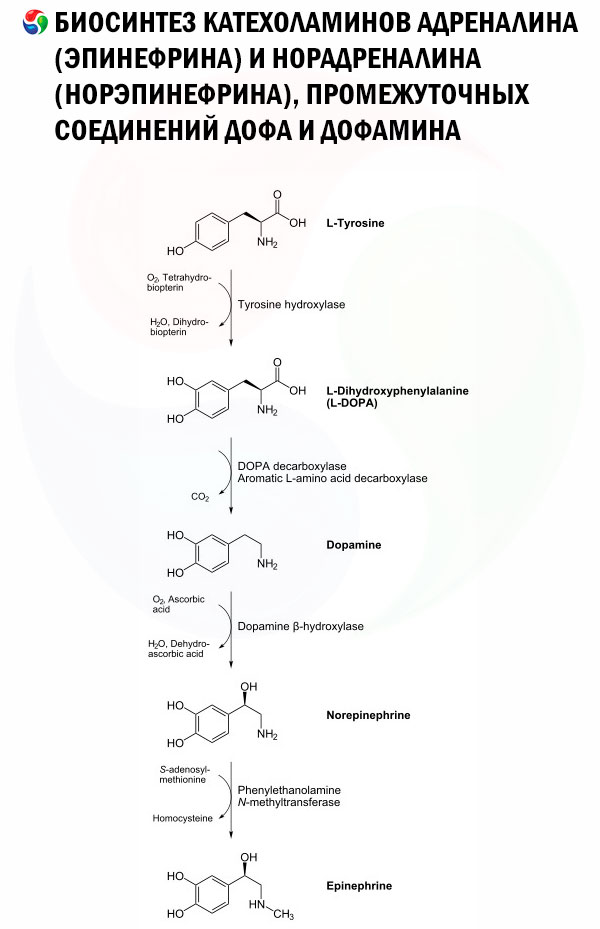
Jeśli osoba regularnie spożywa L-tyrozynę w dużych ilościach, łatwo przekracza ona barierę krew-mózg, podobnie jak L-DOPA. [ 13 ] Jednak jej użyteczność jest ograniczona przestrzennie, ponieważ DA nie może przekroczyć bariery krew-mózg. Jednak jeśli poziom L-tyrozyny jest niski, L-fenyloalanina może zostać przekształcona w L-tyrozynę przez hydroksylazę fenyloalaninową.
Po uwolnieniu DA do przestrzeni synaptycznej, wchodzi ona w interakcję z różnymi receptorami na zakończeniach pre- i postsynaptycznych, powodując pobudzenie lub zahamowanie neuronów docelowych. Istnieją dwie całe rodziny receptorów DA, składające się z pięciu różnych izoform, z których każda wpływa na różne wewnątrzkomórkowe szlaki sygnałowe. [ 14 ] Obie rodziny receptorów dopaminy, D1 i D2, są z definicji receptorami sprzężonymi z białkiem G, ale klasa receptorów D1 powoduje depolaryzację neuronów, podczas gdy receptory D2 tłumią pobudzenie neuronów. [ 15 ]
Po dostaniu się do szczeliny synaptycznej DA jest transportowana z powrotem do neuronu presynaptycznego za pomocą transporterów DA (DAT) w celu ponownego upakowania lub może pozostać w przestrzeni pozakomórkowej w celu wychwytu przez komórki glejowe lub metabolizmu przez błonę komórkową. DA może być metabolizowana pozaneuronalnie przez katecholo-O-metylotransferazę (COMT) do 3-metoksytyraminy (3-MT), podczas gdy monoaminooksydaza-B (MAO-B) szybko metabolizuje 3-MT do kwasu homowanilinowego (HVA). [ 16 ] Ponadto może ulegać metabolizmowi w cytoplazmie, gdzie podwójne działanie MAO-A i aldehydowej dehydrogenazy (ALDH) przekształca DA w kwas fenolowy 3,4-dihydroksyfenylooctowy (DOPAC). [ 17 ]
Biorąc pod uwagę tę złożoną sekwencję, modulacja dopaminy może zachodzić na różnych poziomach, takich jak cały neuron, jego projekcje lub obwody neuronalne układu nerwowego. Ponadto podczas syntezy DA (regulacja transkrypcyjna, translacyjna i potranslacyjna), pakowania synaptosomalnego (regulacja VMAT, transport pęcherzyków do synapsy), uwalniania DA (depolaryzacja neuronalna, sygnalizacja wapniowa, fuzja pęcherzyków) oraz poprzez wychwyt zwrotny i metabolizm poprzez regulację odpowiednich enzymów i ich lokalizację przestrzenną względem ich substratu. [ 18 ]
Jak wspomniano wcześniej, systemowe działanie DA zależy od różnych receptorów (D1, D2, D3, D4 i D5) oraz receptorów alfa- i beta-adrenergicznych. Te receptory sprzężone z G są powszechnie grupowane jako D1 lub D2, głównie na podstawie ich tradycyjnych funkcji biochemicznych wskazujących, że dopamina może modulować aktywność cyklazy adenylanowej. [ 19 ] Jednak na podstawie ich struktury molekularnej, właściwości biochemicznych i funkcji farmakologicznych, receptory DA są dalej klasyfikowane jako klasa D1 (D1 i D5) lub klasa D2 (D2, D3, D4). [ 20 ], [ 21 ]
Aktywacja receptorów D1 na mięśniach gładkich, w kanalikach nerkowych proksymalnych i w cewce zbiorczej kory zwiększa diurezę.[ 22 ] Receptory D2 są zlokalizowane presynaptycznie na nerwach nerkowych, kłębuszkach nerkowych i korze nadnerczy. Aktywacja tych nerwów powoduje zmniejszenie wydalania sodu i wody przez nerki.[ 23 ] Apomorfina jest agonistą receptora DA i może mieć podobną aktywację na tych receptorach DA.[ 24 ] Receptory adrenergiczne również wiążą DA, zwiększając skurcz mięśni gładkich tętnic i przewodzenie w węźle zatokowo-przedsionkowym serca, co wyjaśnia jej korzyści terapeutyczne dla serca.
Chociaż bariera krew-mózg ogranicza konkretnie transfer DA z krążenia systemowego do ośrodkowego układu nerwowego, dalsze badania doprowadziły do odkrycia jej centralnej roli w zachowaniu polegającym na poszukiwaniu nagrody, w którym jej transfer jest wyraźnie zwiększony. Obecne badania nad DA obejmują zmiany epigenetyczne i ich udział w różnych schorzeniach psychiatrycznych, w tym nadużywaniu substancji i uzależnieniu, schizofrenii i zespole deficytu uwagi. [ 25 ], [ 26 ] Ogólnie rzecz biorąc, schorzenia te obejmują zaburzenia w mezolimbicznych i mezokortykalnych szlakach DA. Jednym z powszechnych efektów uzależniających leków w ośrodkowym układzie nerwowym jest zwiększone uwalnianie DA w prążkowiu, co jest typowo związane z wysoką aktywnością lokomotoryczną i stereotypią. [ 27 ] Wzrost stężenia DA w prążkowiu jest wynikiem projekcji aksonowych powstających bezpośrednio z części zwartej istoty czarnej (SN) i obszaru brzusznego nakrywki (VTA), które rzutują na jądro półleżące i ciało migdałowate.[ 28 ],[ 29 ]
Inny obwód DA, szlak tuberoinfundibularny, jest przede wszystkim odpowiedzialny za regulację neuroendokrynnej prolaktyny z przedniego płata przysadki mózgowej, znanej ze swojej roli jako induktora laktacji, ale odgrywa również niewielką rolę w homeostazie wodno-solnej, odpowiedzi immunologicznej i regulacji cyklu komórkowego. [ 30 ], [ 31 ] Szlak nigrostriatalny jest głównym szlakiem zaangażowanym w deficyty motoryczne obserwowane w chorobie Parkinsona. [ 32 ] Szlak ten obejmuje neurony dopaminergiczne pochodzące z istoty czarnej (pars compacta) i rzutujące do prążkowia przez wiązkę przyśrodkowego mózgu przedniego, synapując z wieloma populacjami neuronów w skorupie, jądrze ogoniastym, gałce bladej wewnętrznej (GPi) i jądrze podwzgórzowym (STN). Ta złożona sieć tworzy połączenia aferentne z istoty czarnej do obwodu zaangażowanego w ruch motoryczny, mianowicie zwojów podstawy. W tym ostatnim przypadku DA odgrywa kluczową rolę w kontrolowaniu ruchów motorycznych i uczeniu się nowych umiejętności motorycznych. [ 33 ]
Dawkowanie i administracja
W celu stymulacji układu współczulnego wskazane jest ciągłe podawanie dożylne. Okres półtrwania dopaminy w krążeniu ogólnym wynosi od 1 do 5 minut; w związku z tym wolniejsze formy podawania, takie jak podawanie doustne, są zwykle nieskuteczne.[ 38 ]
Oprócz obwodowych efektów współczulnych, DA jest również krytyczna dla neurologicznych funkcji motorycznych w chorobie Parkinsona. L-DOPA jest podawana doustnie, a po wchłonięciu niewielki procent jest transportowany do mózgu, gdzie neurony wykorzystują ją w zwojach podstawy. L-DOPA jest zwykle podawana łącznie z karbidopą w celu zahamowania obwodowych efektów L-DOPA na współczulny układ nerwowy. Karbidopa jest inhibitorem dekarboksylazy, który zapobiega systemowej konwersji L-DOPA do DA, zmniejszając w ten sposób częste działania niepożądane, takie jak nudności i wymioty.[ 39 ]
Przeciwwskazania
Dożylna dopamina jest przeciwwskazana u pacjentów z chorobami serca lub układu krążenia. Stany te mogą obejmować arytmie komorowe i tachykardię, niedrożność naczyń, niski poziom tlenu we krwi, zmniejszoną objętość krwi, kwasicę i dysfunkcję nadnerczy skutkującą wysokim ciśnieniem krwi, taką jak guz chromochłonny. U pacjentów niedawno leczonych inhibitorami monoaminooksydazy, DA należy początkowo podawać w dawkach frakcyjnych (jedna dziesiąta zwykłej dawki), a dalsze efekty należy ściśle monitorować. Leki stosowane w leczeniu nadciśnienia, takie jak inhibitory receptorów beta- i alfa-adrenergicznych, przeciwdziałają efektom terapeutycznym DA. Haloperidol blokuje również ogólnoustrojowe efekty DA. Donoszono, że lek przeciwdrgawkowy fenytoina powoduje niedociśnienie i zmniejsza częstość akcji serca, gdy jest stosowany z DA. Z drugiej strony trójpierścieniowe leki przeciwdepresyjne zwiększają odpowiedź DA, podobnie jak środki znieczulające, takie jak cyklopropan i halogenowane. W połączeniu z oksytocyną stosowanie DA może prowadzić do przewlekłego nadciśnienia, a także może być przyczyną udarów mózgu.[ 34 ]
Skutki uboczne Dopamina
Podawanie dopaminy może niekorzystnie wpływać na pracę nerek, powodując zwiększone oddawanie moczu i nieregularne bicie serca. [ 35 ] Nadmierne podawanie dopaminy może powodować niebezpieczne schorzenia, takie jak udary mózgowo-naczyniowe spowodowane wzrostem ciśnienia krwi w mózgu. [ 36 ]
Jak wspomniano wcześniej, neuroprzekaźnik DA działa również w centralnym szlaku mezokortykolimbicznym i odgrywa rolę w przetwarzaniu nagrody i strachu, a także w skupianiu uwagi i funkcjonowaniu wykonawczym, w tym w złożonym planowaniu. Podczas gdy systemowa dopamina nie przekracza bariery krew-mózg, centralna dopamina jest powiązana z sennością, schizofrenią, uzależnieniem i zaburzeniami kontroli impulsów. [ 37 ] Pacjenci z chorobami neurologicznymi stosujący duże dawki L-DOPA w leczeniu choroby Parkinsona mogą doświadczać takich zmian fizjologicznych z powodu dysregulacji DA w szlakach ośrodkowego układu nerwowego.
Warunki przechowywania
W miejscu osłoniętym od światła.
Specjalne instrukcje
Konieczne jest monitorowanie ciśnienia krwi i przepływu moczu — zaleca się również monitorowanie bardziej złożonych parametrów hemodynamicznych, takich jak rzut serca, w tym rytm i ciśnienie zaklinowania płucnego. Warto zauważyć, że agoniści dopaminy i mimetyki, które przenikają przez barierę krew-mózg, oddziałują z obwodami neurologicznymi zaangażowanymi w funkcje motoryczne, wykonawcze i limbiczne, w tym z układami nagrody związanymi z uzależnieniem, mechanizmami kontroli impulsów i pobudzeniem. W związku z tym przerwanie terapii DA może prowadzić do stanu zwanego zespołem odstawienia agonisty dopaminy. Stan ten ma szeroki zakres objawów, w tym lęk, depresję, ataki paniki, zmęczenie, niedociśnienie, nudności, drażliwość, a nawet myśli samobójcze. [ 43 ] Dlatego pacjentom zaleca się stopniowe odstawianie tych centralnie działających agonistów DA.
Okres przydatności do spożycia
Okres przydatności do spożycia wynosi 2 lata.
Niedobór dopaminy
Istnieje wiele badań, które badają rolę dopaminy w uczestnictwie ruchów, funkcji sensomotorycznych. Zatem przy niedoborze dopaminy w zakończeniach dopaminergicznych bez interwencji farmakologicznej lub terapii genowej, a zatem przy wyczerpaniu DA, stwierdza się defekty w wielu z tych funkcji. [ 44 ]
Nadmiar dopaminy
W tym przypadku musimy rozważyć takie zjawisko na przykładzie. Więc człowiek zaczyna dietę i jest zdeterminowany, aby skończyć to, co zaczął. Ale wtedy trafia mu się pyszne ciasto i wszystko się kończy. Tak więc człowiek po prostu przestaje się kontrolować. Potrzebuje dawki „hormonu szczęścia” i to właśnie ta słodka radość może ją „spowodować”. Więc jedząc jedno ciasto, potem drugie, człowiek po prostu nie jest w stanie przestać. Tak więc pojawia się ten właśnie nadmiar dopaminy. Nie ma w tym nic strasznego. Ale człowiekowi jest dość trudno przestać.
Ostatecznie, „uzależniając się” od kolejnego „słodzika” życia, po prostu nie da się sprawować kontroli. Człowiek nie jest już w stanie tego robić. Nadal robi to samo i w ten sposób tyje lub pogarsza swoje zdrowie. Wszystko zależy od tego, jaką rolę odgrywa ten właśnie hormon szczęścia.
Dopamina może wpływać na wiele aspektów świadomej aktywności. Należy obniżyć jej poziom i nie dopuszczać do nadmiaru. Ale to może być również „niebezpieczne”, ponieważ obniżenie impulsywności może prowadzić do uszkodzenia innych równie ważnych funkcji.
Inhibitory wychwytu zwrotnego dopaminy
Inhibitory wychwytu zwrotnego dopaminy (DRI) to klasa leków, które działają jako inhibitory wychwytu zwrotnego neuroprzekaźnika monoaminowego dopaminy, blokując działanie transportera dopaminy (DAT). Hamowanie wychwytu zwrotnego jest osiągane, gdy pozakomórkowa dopamina, która nie jest pobierana przez neuron postsynaptyczny, zostaje zablokowana przed ponownym wejściem do neuronu presynaptycznego. Powoduje to zwiększenie pozakomórkowego stężenia dopaminy i zwiększenie neurotransmisji dopaminergicznej.[ 48 ]
Inhibitory wychwytu zwrotnego dopaminy są stosowane w leczeniu zespołu nadpobudliwości psychoruchowej z deficytem uwagi (ADHD) i narkolepsji ze względu na ich działanie psychostymulujące oraz w leczeniu otyłości i zaburzeń objadania się z powodu ich działania hamującego apetyt. Są czasami stosowane jako leki przeciwdepresyjne w leczeniu zaburzeń nastroju, ale ich stosowanie jako leków przeciwdepresyjnych jest ograniczone, ponieważ silne inhibitory wychwytu zwrotnego dopaminy mają wysoki potencjał nadużywania i ograniczenia prawne dotyczące ich stosowania. Brak wychwytu zwrotnego dopaminy i zwiększone poziomy dopaminy pozakomórkowej są związane ze zwiększoną podatnością na zachowania uzależniające, gdy zwiększa się neuroprzekaźnictwo dopaminergiczne. Uważa się, że szlak dopaminergiczny jest silny w ośrodkach nagrody. Wiele inhibitorów wychwytu zwrotnego dopaminy, takich jak kokaina, to narkotyki nadużywane ze względu na nagradzające efekty wywoływane przez zwiększone stężenia dopaminy synaptycznej w mózgu.
Następujące leki mają aktywność DRI i były lub są stosowane klinicznie specjalnie ze względu na tę właściwość: amineptyna, deksmetylofenidat, difemetoreks, fenkamfamina, lefetamina, lewofacetofenon, medifoksamina, mezokarb, metylofenidat, nomifensyna, pipradrol, prolintan i pirowaleron. Następujące leki są lub były stosowane klinicznie i mają jedynie słabą aktywność DRI, która może mieć lub nie mieć znaczenia klinicznego: adrafinil, armodafinil, bupropion, mazindol, modafinil, nefazodon, sertralina i sibutramina.
Blokery dopaminy
Ekspresja wielu zachowań bezwarunkowych i warunkowych może zostać zaburzona przez leki będące antagonistami receptorów D1 i D2. Na przykład antagoniści receptorów D1 i D2 zmniejszają aktywność lokomotoryczną [ 49 ], [ 50 ], [ 51 ] i tempo zachowań instrumentalnych motywowanych apetytem. [ 52 ], [ 53 ], [ 54 ], [ 55 ] Jednak przynajmniej jeden aspekt ekspresji behawioralnej, czas trwania aktów behawioralnych, wydaje się być stosunkowo specyficznie modulowany przez antagonistów receptora D2 (w porównaniu do D1).
Wcześniej zaobserwowaliśmy, że systemowa blokada receptora D1 zmniejsza odsetek prób, w których bodziec warunkowy (CS) wywołuje reakcję zbliżeniową, efekt, którego nie zaobserwowaliśmy po blokadzie receptora D2.[ 56 ] Inne badania podobnie wykazały, że ekspresja sygnału-odpowiedzi jest upośledzona przez blokadę receptora D1,[ 57 ], ale nie D2,[ 58 ],[ 59 ], chociaż w kilku badaniach zaobserwowano upośledzenie ekspresji sygnału-odpowiedzi wywołane przez antagonistę D2.[ 60 ],[ 61 ]
Wymiana dopaminy
Czy wiesz, jak wymienia się dopaminę? Obecnie trwają intensywne poszukiwania środków, które mają działanie dopaminergiczne. W wyniku jej przewlekłego niedoboru mogą rozwijać się różne zmiany w stanie funkcjonalnym receptorów.
Długotrwałe leczenie może powodować nieodwracalne zmiany w receptorach dopaminergicznych. Nie zatrzymuje to jednak postępującej degeneracji neuronu presynaptycznego. Dlatego też poszukiwano specjalnych środków, które mogłyby stymulować receptory postsynaptyczne i uczynić je bardziej wrażliwymi na leczenie. Należą do nich agoniści dopaminergiczny. Istnieją jednak również pewne obawy. Tak więc, jeśli agoniści dopaminergiczny są stosowane przez długi czas, może to prowadzić do zahamowania aktywności hydroksylazy tyrozynowej.
 [ 62 ], [ 63 ], [ 64 ], [ 65 ], [ 66 ], [ 67 ]
[ 62 ], [ 63 ], [ 64 ], [ 65 ], [ 66 ], [ 67 ]
Produkcja dopaminy
Naukowcy udowodnili, że każda aktywność, która może przynieść przyjemność, prowadzi do produkcji hormonu szczęścia. Dlatego nie ma znaczenia, co człowiek robi, najważniejsze jest to, że sprawia mu to radość. Ale naturalnie aktywności powinny mieścić się w rozsądnych granicach. Jeśli wykluczymy wszystkie radości, poziom dopaminy znacznie się obniży, a człowiek może popaść w depresję.
Należy zrozumieć, że dopamina została przypisana do pewnego rodzaju uzależnienia od narkotyków. Ponieważ osoba, która kocha ciasta, je je je nieustannie, aby poprawić sobie nastrój. Co prowadzi do innych problemów, takich jak zły stan zdrowia, nadwaga itp. Jeśli odbierzesz sobie „radość”, pojawi się depresja, a nastrój się pogorszy. Ostatecznie jest to błędne koło. Dlatego musisz wybrać bardziej pożyteczne zajęcia.
Najłatwiejszym i najprzyjemniejszym sposobem na wywołanie „produkcji” dopaminy jest regularne uprawianie seksu. Tylko jeśli ta aktywność naprawdę przynosi przyjemność.
 [ 68 ], [ 69 ], [ 70 ], [ 71 ]
[ 68 ], [ 69 ], [ 70 ], [ 71 ]
Dopamina i schizofrenia
Początki hipotezy dopaminy leżą w dwóch liniach dowodowych. Po pierwsze, badania kliniczne wykazały, że agonisty dopaminergiczne i stymulanty mogą wywoływać psychozę u zdrowych osób i pogarszać psychozę u pacjentów ze schizofrenią. [ 72 ] Po drugie, odkryto, że leki przeciwpsychotyczne wpływają na układ dopaminowy. [ 73 ] Później skuteczność leków przeciwpsychotycznych powiązano z ich powinowactwem do receptorów dopaminowych D2, łącząc działanie molekularne z fenotypem klinicznym. [ 74 ]
Badania post mortem dostarczyły pierwszych bezpośrednich dowodów na dysfunkcję dopaminergiczną w mózgu i jego anatomiczną lokalizację. Wykazały one podwyższone poziomy dopaminy, jej metabolitów i receptorów w prążkowiu osób ze schizofrenią. [ 75 ], [ 76 ] Jednakże badania obejmowały pacjentów przyjmujących leki przeciwpsychotyczne. Dlatego też nie było jasne, czy dysfunkcja była związana z początkiem lub końcowym stadium zaburzenia, czy też z efektami leków przeciwpsychotycznych.
 [ 77 ], [ 78 ], [ 79 ], [ 80 ], [ 81 ], [ 82 ], [ 83 ], [ 84 ], [ 85 ], [ 86 ]
[ 77 ], [ 78 ], [ 79 ], [ 80 ], [ 81 ], [ 82 ], [ 83 ], [ 84 ], [ 85 ], [ 86 ]
Dopamina i dopamina
Nie ma więc różnicy między tymi substancjami. Ponieważ w istocie są takie same. Ta substancja jest produkowana w ciele i działa jako neuroprzekaźnik. Mówiąc prościej, pomaga komórkom mózgowym przekazywać pewne wiadomości. W potocznym języku ta substancja jest nazywana hormonem szczęścia.
Produkcja dopaminy prowadzi do wzrostu aktywności, dobrego nastroju, wysokiego poziomu energii, a także poprawy pamięci i uwagi. W rzeczywistości korzyści jest wiele. Warto zauważyć, że substancja ta może być produkowana pod wpływem „słodzików” życia. Może to być zarówno jedzenie, jak i ćwiczenia fizyczne. Mówiąc prościej, to, co sprawia, że człowiek jest szczęśliwy, stymuluje produkcję tego hormonu. Dlatego też należy częściej robić to, co przynosi pełną satysfakcję.
Dopamina i dopamina to ta sama substancja, pełniąca tę samą funkcję. Ważne jest utrzymanie poziomu hormonu radości, a wtedy życie stanie się bardziej satysfakcjonujące.
Wpływ alkoholu na układ dopaminowy
Neurony dopaminergiczne, które przekazują informacje do jądra półleżącego (NAc) są niezwykle wrażliwe na alkohol. Na przykład w badaniach na szczurach alkohol podawany do krwi w ilości od 2 do 4 miligramów na kilogram masy ciała zwiększał uwalnianie dopaminy w jądrze półleżącym i wspierał przewlekłe samodzielne przyjmowanie alkoholu. [ 89 ] U szczurów doustne spożycie alkoholu stymuluje również uwalnianie dopaminy w NAc. [ 90 ] Jednak ta droga podawania wymaga wyższych dawek alkoholu, aby osiągnąć ten sam efekt, co wstrzykiwanie alkoholu bezpośrednio do krwi. [ 91 ]
Stymulacja uwalniania dopaminy w NAc wywołana alkoholem może wymagać aktywności innej kategorii neuromodulatorów, endogennych peptydów opioidowych. Hipotezę tę potwierdza obserwacja, że substancje chemiczne, które hamują działanie endogennych peptydów opioidowych (tj. antagoniści peptydów opioidowych) zapobiegają wpływowi alkoholu na uwalnianie dopaminy. Antagoniści peptydów opioidowych działają przede wszystkim na obszar mózgu, w którym powstają neurony dopaminergiczne, które projektują się do NAc. Obserwacje te sugerują, że alkohol stymuluje aktywność endogennych peptydów opioidowych, co pośrednio prowadzi do aktywacji neuronów dopaminergicznych. Antagoniści peptydów opioidowych mogą zakłócać ten proces, zmniejszając w ten sposób uwalnianie dopaminy.
Działanie alkoholu jako środka wzmacniającego: rola dopaminy
Chociaż liczne badania próbowały wyjaśnić rolę dopaminy w procesie wzmacniania po spożyciu alkoholu poprzez manipulowanie sygnałami dopaminergicznymi, badania te nie pozwalają na wyciągnięcie żadnych jednoznacznych wniosków. [ 92 ] Jednak porównanie wpływu alkoholu z wpływem powszechnie występujących czynników wzmacniających, takich jak żywność, dostarcza pewnych wskazówek na temat roli dopaminy w pośredniczeniu w procesie wzmacniania po spożyciu alkoholu.
Przyjemne jedzenie aktywuje sygnalizację dopaminergiczną w powłoce NAc, na przykład poprzez dostarczanie pewnych bodźców sensorycznych (np. smaku lub aromatu). Alkohol podawany doustnie podobnie aktywuje receptory smakowe, zwiększając w ten sposób uwalnianie dopaminy w NAc. Jednak w przeciwieństwie do jedzenia alkohol może bezpośrednio zmieniać funkcję neuronów dopaminergicznych po dotarciu do mózgu. W związku z tym alkohol doustny wpływa na uwalnianie dopaminy w NAc zarówno poprzez swoje właściwości smakowe (tj. jako konwencjonalny wzmacniacz), jak i poprzez swoje bezpośrednie działanie na mózg (tj. jako wzmacniacz leku). Zgodnie z tą hipotezą, w NAc występują dwa szczyty uwalniania dopaminy. Pierwszy szczyt wynika z bodźców smakowych związanych z alkoholem; drugi wynika z efektów alkoholu w mózgu. W konsekwencji, wywołana alkoholem bezpośrednia aktywacja sygnalizacji dopaminergicznej może wzmacniać właściwości motywacyjne bodźców smakowych związanych z alkoholem. W wyniku tego mechanizmu, bodźce smakowe związane z alkoholem nabywają silnych właściwości motywujących (tj. stają się bodźcami motywującymi, które motywują pijącego do poszukiwania większej ilości alkoholu). Podobnie, bodźce apetytu związane z alkoholem (np. bodźce zewnętrzne, takie jak pojawienie się określonej marki napoju alkoholowego lub pojawienie się baru) również nabywają właściwości motywujących i promują poszukiwanie i konsumpcję alkoholu. Poprzez te złożone mechanizmy, uwalnianie dopaminy wywołane alkoholem aktywuje wtórny obwód wzmacniający, który promuje konsumpcję alkoholu.
Rola dopaminy w rozwoju uzależnienia od alkoholu
Uwalnianie dopaminy w powłoce NAc może przyczyniać się do rozwoju uzależnienia od alkoholu. Psychologiczne uzależnienie od alkoholu rozwija się, ponieważ bodźce związane z alkoholem nabywają nadmiernych właściwości motywacyjnych, które powodują silne pragnienie spożywania napojów alkoholowych (tj. pragnienie). W wyniku tego silnego pragnienia normalne wzmacniacze (np. jedzenie, seks, rodzina, praca lub hobby) tracą swoje znaczenie i mają jedynie mniejszy wpływ na zachowanie pijącego.
Jednym z mechanizmów, który może być odpowiedzialny za nieprawidłowe znaczenie wskazówek związanych z alkoholem, jest niedostosowawcza natura wywołanej alkoholem regulacji w górę sygnalizacji dopaminergicznej w NAc. Jak wspomniano wcześniej, zwiększone uwalnianie dopaminy w powłoce NAc wywołane przez normalne wzmacniacze (np. jedzenie) szybko prowadzi do przyzwyczajenia, a powtarzająca się prezentacja skojarzonych bodźców nie wywołuje już uwalniania dopaminy. Natomiast po wielokrotnym spożyciu alkoholu nie występuje żadne przyzwyczajenie. W wyniku uporczywego uwalniania dopaminy w powłoce NAc w odpowiedzi na alkohol, bodźce związane z alkoholem nabywają nieprawidłowego znaczenia emocjonalnego i motywacyjnego, co prowadzi do nadmiernej kontroli nad zachowaniem pijącego. Ta nadmierna kontrola leży u podstaw uzależnienia.
 [ 93 ], [ 94 ], [ 95 ], [ 96 ], [ 97 ]
[ 93 ], [ 94 ], [ 95 ], [ 96 ], [ 97 ]
Palenie i dopamina
Zaburzenia związane z używaniem tytoniu są uwarunkowane różnymi czynnikami środowiskowymi i genetycznymi. Czynniki środowiskowe obejmują szeroki zakres aspektów kulturowych, społecznych i ekonomicznych. Czynniki genetyczne można podzielić na dwie główne grupy: geny związane ze ścieżkami związanymi z metabolizmem nikotyny, które wskazują, jak szybko ktoś metabolizuje nikotynę do kotyniny, oraz geny związane z teorią kaskady nagrody, która dotyczy ilości przyjemności odczuwanej podczas palenia. Najważniejszymi genami wpływającymi na metabolizm nikotyny są cytochrom P450 CYP2A6 i CYP2B6. Geny wpływające na teorię kaskady nagrody obejmują złożoną sieć serotoniny, opioidów, kwasu gamma-aminomasłowego (GABA) i dopaminy.[ 98 ]
Więcej informacji na temat badań nad genami kandydującymi do dopaminy i paleniem znajdziesz w tym artykule.
Jak zwiększyć poziom dopaminy?
W rzeczywistości nie ma nic skomplikowanego w tym procesie. Musisz spróbować uwzględnić w swoim codziennym planie te czynności, które mogą przynieść radość.
Ale to nie wszystko. Dlatego zaleca się jedzenie bananów każdego dnia. Zawierają one substancję podobną do dopaminy. Małe brązowe plamki na owocach zawierają większą ilość tej pożytecznej „substancji”. Dieta powinna być uzupełniona o produkty zawierające przeciwutleniacze. Należą one do wolnych rodników, które same w sobie zwiększają poziom dopaminy. Do takich produktów zalicza się fasolę czerwoną, żurawinę, karczochy, truskawki, śliwki i borówki.
Warto zrezygnować z kawy bezkofeinowej, zacząć spożywać mniej cukru i ograniczyć spożycie napojów alkoholowych. Zaleca się spożywanie garści migdałów dziennie, odpowiednie są również nasiona słonecznika. Wskazane jest również spożywanie sezamu, będzie on świetnym dodatkiem do każdej sałatki i kanapki zawierającej świeże warzywa.
Dopamina w żywności
Dopamina odgrywa ważną rolę w organizmie człowieka w koordynacji ruchów ciała, motywacji i nagrody. Informacje dotyczące zawartości produktów dopaminowych są bardzo ograniczone, prawdopodobnie z powodu braku zainteresowania klinicznego. Owoce z rodzaju Musa, takie jak banany i sykomory, oraz gatunek M. Persea americana (tj. awokado) zawierają wysoki poziom dopaminy. [ 102 ] W szczególności poziomy dopaminy wykryto w skórce banana (700 μg/g), miąższu banana (8 μg/g) i w awokado (4–5 μg/g). W roślinach dopamina odgrywa rolę ochronną i bierze udział w organogenezie rozrodczej, przepuszczalności jonów, aktywności antyoksydacyjnej [ 103 ] i w tworzeniu alkaloidów. [ 104 ] Co ciekawe, wykazano, że liście Mucuna pruriens L. (czyli fasoli aksamitnej) zawierają dopaminę, [ 105 ] która prawdopodobnie uczestniczy w dobrze znanym działaniu przeciwparkinsonowskim produktów pochodzących z nasion. [ 106 ] Niskie poziomy zmierzono w Citrus sinensis L. (czyli pomarańczy), Malus sylvestris L. (czyli jabłoni drzewnej), pomidorach, bakłażanach, szpinaku, grochu i fasoli. Po spożyciu odtłuszczonego mleka zgłaszano epizodyczne zaburzenia ruchowe (czyli potrząsanie głową z boku na bok). Ci sami autorzy przypisali te efekty wysokiej zawartości L-tyrozyny w produktach mlecznych. [ 107 ] Nie można jednak wykluczyć możliwej interakcji dopaminy, ale dane z literatury są niewystarczające.
Uwaga!
Aby uprościć postrzeganie informacji, niniejsza instrukcja użycia narkotyku "Dopamina" została przetłumaczona i przedstawiona w specjalnej formie na podstawie oficjalnych instrukcji użycia leku w celach medycznych. Przed użyciem przeczytaj adnotację, która przyszła bezpośrednio do leku.
Opis dostarczony w celach informacyjnych i nie jest wskazówką do samoleczenia. Potrzebę tego leku, cel schematu leczenia, metody i dawkę leku określa wyłącznie lekarz prowadzący. Samoleczenie jest niebezpieczne dla twojego zdrowia.

