Ekspert medyczny artykułu
Nowe publikacje
Ludzki wirus niedoboru odporności (HIV)
Ostatnia recenzja: 04.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Zespół nabytego niedoboru odporności został zidentyfikowany jako odrębna choroba w 1981 roku w Stanach Zjednoczonych, kiedy to u wielu młodych ludzi rozwinęły się poważne choroby wywołane przez mikroorganizmy, które były niepatogenne lub słabo patogenne dla zdrowych ludzi. Badanie stanu odporności pacjentów wykazało gwałtowny spadek liczby limfocytów w ogóle, a w szczególności limfocytów T pomocniczych. Stan ten nazwano AIDS (zespół nabytego niedoboru odporności). Sposób zakażenia (kontakt seksualny, poprzez krew i jej preparaty) wskazywał na zakaźny charakter choroby.
Czynnik wywołujący AIDS został odkryty w 1983 roku, niezależnie przez Francuza L. Montagniera, który nazwał go LAV Lymphoadenopathy Associated Virus, ponieważ znalazł go u pacjenta z limfadenopatią; oraz Amerykanina R. Gallo, który nazwał wirusa HTLV-III (Human T-lymphotropic Virus III): wcześniej odkrył on wirusy limfotropowe I i II.
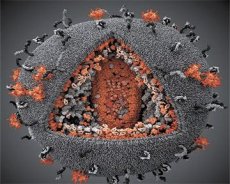
Porównanie właściwości wirusów LAV i HTLV-III wykazało ich tożsamość, więc aby uniknąć pomyłek, w 1986 r. wirus nazwano HIV (Human Immunodeficiency Virus, lub HIV). HIV ma kształt kulisty, o średnicy 110 nm. Otoczka wirusa ma kształt wielościanu, złożonego z 12 pięciokątów i 20 sześciokątów. W centrum i na rogach każdego sześciokąta znajduje się cząsteczka glikozylowanego białka gpl20 (liczba 120 oznacza masę cząsteczkową białka w kilodaltonach). Łącznie 72 cząsteczki gpl20 znajdują się na powierzchni wirionu w postaci osobliwych kolców, z których każdy jest związany z wewnątrzbłonowym białkiem gp41. Te białka, wraz z podwójną warstwą lipidową, tworzą superkapsyd (błonę) wirionu.
Białka gpl20 i gp41 powstają przez przecięcie białka prekursorowego Env przez komórkową proteazę. Białko gp41 tworzy „łodygę” kolca, wiążąc się ze swoją domeną cytoplazmatyczną do białka macierzy p17MA znajdującego się bezpośrednio pod otoczką. Cząsteczki p17 oddziałują ze sobą podczas dojrzewania wirionu, tworząc dwudziestościan leżący pod otoczką.
W centralnej części wirionu białko p24 tworzy stożkowaty kapsyd. Zwężona część kapsydu jest połączona z błoną wirionu przy udziale białka rb. Wewnątrz kapsydu znajdują się dwie identyczne cząsteczki wirusowego genomowego RNA. Są one połączone końcami 5' z białkiem nukleokapsydu p7NC. To białko jest interesujące, ponieważ ma dwie reszty aminokwasowe (motywy) bogate w cysteinę i histydynę oraz zawierające atom Zn - są one nazywane „palcami cynkowymi”, ponieważ wychwytują cząsteczki genomowego RNA w celu włączenia do tworzących się wirionów. Kapsyd zawiera również trzy enzymy. Revertaza (RT), czyli kompleks pol, obejmuje odwrotną transkryptazę, RNazę H i zależną od DNA polimerazę DNA. Revertaza występuje jako heterodimer p66/p51. Proteaza (PR) - p10, inicjuje i realizuje proces dojrzewania wirionu. Integraza (IN) - p31, czyli endonukleaza, zapewnia włączenie prowirusowego DNA do genomu komórki gospodarza. Kapsyd zawiera również cząsteczkę primer RNA (tRNAl"3).
Genom RNA w komórce jest przekształcany w genom DNA (DNA provirus) za pomocą odwrotnej transkryptazy, składający się z 9283 par nukleotydów. Jest on ograniczony z lewej i prawej strony przez tzw. długie powtórzenia końcowe, lub LTR: S'-LTR po lewej i 3'-LTR po prawej. LTR zawierają po 638 par nukleotydów.
Genom HIV składa się z 9 genów, z których niektóre zachodzą na siebie na końcach (mają kilka ramek odczytu) i mają strukturę egzointronu. Kontrolują one syntezę 9 białek strukturalnych i 6 białek regulacyjnych.
Znaczenie LTR dla genomu wirusa polega na tym, że zawierają one następujące elementy regulacyjne, które kontrolują jego funkcjonowanie:
- sygnał transkrypcyjny (region promotorowy);
- sygnał dodania poli-A;
- sygnał ograniczający;
- sygnał integracji;
- sygnał regulacji pozytywnej (TAR dla białka TAT);
- negatywny element regulacyjny (NRE dla białka NEF);
- miejsce przyłączania primerowego RNA (tRNA™3) do syntezy ujemnej nici DNA na końcu 3'; sygnał na końcu 5' LTR, który służy jako primer do syntezy dodatniej nici DNA.
Ponadto LTR zawiera elementy biorące udział w regulacji splicingu mRNA, pakowaniu cząsteczek vRNA do kapsydu (element Psi). Na koniec, podczas transkrypcji genomu, w długich mRNA dla białka REV powstają dwa sygnały, które przełączają syntezę białek: CAR - dla białek regulacyjnych i CRS - dla białek strukturalnych. Jeśli białko REV wiąże się z CAR, syntetyzowane są białka strukturalne; jeśli jest nieobecne, syntetyzowane są tylko białka regulacyjne.
Szczególnie ważną rolę w regulacji funkcjonowania genomu wirusa odgrywają następujące geny regulacyjne i ich białka:
- Białko TAT, które przeprowadza pozytywną kontrolę replikacji wirusa i działa poprzez region regulacyjny TAR;
- Białka NEV i VPU, które wywierają negatywną kontrolę replikacji poprzez region NRE;
- Białko REV, które wykonuje kontrolę dodatnio-ujemną. Białko REV kontroluje pracę genów gag, pol, env i wykonuje negatywną regulację splicingu.
W ten sposób replikacja wirusa HIV znajduje się pod potrójną kontrolą – pozytywną, negatywną i pozytywno-negatywną.
Białko VIF decyduje o zakaźności nowo syntetyzowanego wirusa. Jest ono związane z białkiem kapsydu p24 i występuje w wirionie w ilości 60 cząsteczek. Białko NEF jest reprezentowane w wirionie przez niewielką liczbę cząsteczek (5-10), prawdopodobnie związanych z otoczką.
Białko VPR hamuje cykl komórkowy w fazie G2, uczestniczy w transporcie kompleksów preintegracyjnych do jądra komórkowego, aktywuje niektóre geny wirusowe i komórkowe oraz zwiększa wydajność replikacji wirusa w monocytach i makrofagach. Lokalizacja białek VPR, TAT, REV i VPU w wirionie nie została ustalona.
Oprócz własnych białek błona wirionu może zawierać niektóre białka komórki gospodarza. Białka VPU i VPR uczestniczą w regulacji reprodukcji wirusa.
Warianty antygenowe wirusa niedoboru odporności ludzkiej (HIV)
Ludzki wirus niedoboru odporności (HIV) jest bardzo zmienny. Nawet z organizmu jednego pacjenta można wyizolować szczepy wirusa, które różnią się znacząco właściwościami antygenowymi. Taka zmienność jest ułatwiona przez intensywne niszczenie komórek CD4+ i silną odpowiedź przeciwciał na zakażenie HIV. Nowa forma HIV, HIV-2, biologicznie zbliżona do HIV-1, ale immunologicznie od niego różna, została wyizolowana od pacjentów z Afryki Zachodniej. Homologia struktury pierwotnej genomów tych wirusów wynosi 42%. Prowirus DNA HIV-2 zawiera 9671 pz, a jego LTR - 854 pz. HIV-2 został następnie wyizolowany w innych regionach świata. Nie ma odporności krzyżowej między HIV-1 i HIV-2. Znane są dwie duże formy HIV-1: O (Outlier) i M (Major), ta ostatnia dzieli się na 10 podtypów (AJ). Osiem podtypów (AH) krąży w Rosji.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mechanizm oddziaływania wirusa HIV z komórką
Po wniknięciu do organizmu wirus najpierw atakuje komórki zawierające specyficzny dla niego receptor CD4. Receptor ten występuje w dużych ilościach w komórkach pomocniczych T, w mniejszych ilościach w makrofagach i monocytach, a komórki pomocnicze T są szczególnie wrażliwe na wirusa.
Wirus niedoboru odporności ludzkiej (HIV) rozpoznaje receptory CD4 za pomocą swojego białka gpl20. Proces interakcji HIV z komórką przebiega według następującego schematu: adsorpcja zależna od receptora -> opłaszczony dołek -> opłaszczony pęcherzyk -> lizosom. W nim błona wirionu łączy się z błoną lizosomu, a uwolniony od superkapsydu nukleokapsyd wnika do cytoplazmy; w drodze do jądra zostaje zniszczony, a genomowe RNA i powiązane składniki rdzenia zostają uwolnione. Następnie odwrotna transkryptaza syntetyzuje nić minus DNA na RNA wirionu, następnie RNaza H niszczy RNA wirionu, a wirusowa polimeraza DNA syntetyzuje nić plus DNA. 5'-LTR i 3'-LTR powstają na końcach prowirusa DNA. Prowirus DNA może pozostać w jądrze przez jakiś czas w formie nieaktywnej, ale prędzej czy później zostaje zintegrowany z chromosomem komórki docelowej za pomocą swojej integrazy. W nim prowirus pozostaje nieaktywny, dopóki dany limfocyt T nie zostanie aktywowany przez antygeny drobnoustrojów lub inne immunokompetentne komórki. Aktywacja transkrypcji komórkowego DNA jest regulowana przez specjalny czynnik jądrowy (NF-kB). Jest to białko wiążące DNA i jest produkowane w dużych ilościach podczas aktywacji i proliferacji limfocytów T i monocytów. Białko to wiąże się z pewnymi sekwencjami komórkowego DNA i podobnymi sekwencjami LTR prowirusa DNA i indukuje transkrypcję zarówno komórkowego DNA, jak i prowirusa DNA. Indukując transkrypcję prowirusa DNA, przeprowadza przejście wirusa ze stanu nieaktywnego do aktywnego i odpowiednio z infekcji trwałej do produktywnej. Prowirus może pozostawać w stanie nieaktywnym przez bardzo długi czas. Aktywacja wirusa stanowi krytyczny moment w jego interakcji z komórką.
Od momentu wniknięcia wirusa do komórki rozpoczyna się okres zakażenia HIV - stan nosicielstwa wirusa, który może trwać 10 lat lub dłużej; a od momentu aktywacji wirusa rozpoczyna się choroba - AIDS. Za pomocą swoich genów regulacyjnych i ich produktów wirus zaczyna aktywnie się rozmnażać. Białko TAT może zwiększyć tempo rozmnażania wirusa 1000 razy. Transkrypcja wirusa jest złożona. Obejmuje ona powstawanie zarówno pełnowymiarowego, jak i subgenomowego mRNA, splicing mRNA, a następnie następuje synteza białek strukturalnych i regulacyjnych.
Synteza białek strukturalnych przebiega następująco. Najpierw syntetyzuje się prekursorowe poliproteiny Pr55Gag (białko o masie cząsteczkowej 55 kDa). Zawiera ona 4 główne domeny: macierz (MA), kapsyd (CA), nukleokapsyd (NC) i domenę rb, z której w wyniku przecięcia Pr55Gag przez wirusową proteazę (jest ona samoistnie odcinana od innego białka prekursorowego, Gag-Pol), powstają odpowiednio białka strukturalne p17, p24, p7 i rb. Powstawanie poliproteiny Pr55Gag jest głównym warunkiem powstawania cząstek wirusowych. To właśnie to białko determinuje program morfogenezy wirionu. Kolejno obejmuje etapy transportu poliproteiny Gag do błony plazmatycznej, interakcję z nią oraz interakcje białko-białko podczas powstawania cząstki wirusowej i jej pączkowania. Pr55Gag jest syntetyzowany na wolnych polirybosomach; Cząsteczki białka są transportowane do błony, gdzie są zakotwiczone przez swoje regiony hydrofobowe. Domena CA odgrywa główną rolę w tworzeniu natywnej konformacji białka Gag. Domena NC zapewnia włączenie (za pomocą swoich „palców cynkowych”) 2 cząsteczek genomowego RNA do składu tworzącej się cząstki wirusa. Cząsteczka poliproteiny początkowo dimeryzuje z powodu interakcji domen matrycowych. Następnie dimery łączą się w kompleksy heksameryczne (po 6 jednostek) w wyniku interakcji domen CA i NC. Na koniec heksamery, łącząc się na swoich powierzchniach bocznych, tworzą niedojrzałe kuliste wiriony, wewnątrz których znajduje się genomowy wirusowy RNA, przechwycony przez domenę NC.
Inne białko prekursorowe, Prl60Gag-Pol (białko o masie cząsteczkowej 160 kDa), jest syntetyzowane w wyniku przesunięcia ramki odczytu przez rybosom podczas translacji 3'-końca genu gag w regionie znajdującym się bezpośrednio przed regionem kodującym białko rb. To polibiałko Gag-Pol zawiera niekompletną sekwencję białka Gag (1-423 aminokwasy) i sekwencje Pol, które obejmują domeny PR, RT i IN. Cząsteczki polibiałka Gag-Pol są również syntetyzowane na wolnych polirybosomach i są transportowane do błony plazmatycznej. Polibiałko Prl60Gagpol zawiera wszystkie miejsca interakcji międzycząsteczkowych i miejsca wiązania błony inherentne dla polibiałka Gag. Dlatego cząsteczki polibiałka Gag-Pol łączą się z błoną i wraz z cząsteczkami Gag są włączane do tworzących się wirionów, co skutkuje pojawieniem się aktywnej proteazy i rozpoczęciem procesu dojrzewania wirionu. Proteaza HIV-1 jest wysoce aktywna tylko w formie dimeru, dlatego do jej samoistnego wycięcia z Prl60Gag-Pol wymagana jest dimeryzacja tych cząsteczek. Dojrzewanie wirionu polega na tym, że uwolniona aktywna proteaza tnie prl60Gag-Pol i Gag55 w miejscach przez nią rozpoznawanych; powstają białka p17, p24, p7, p6, rewersaza, integraza i następuje ich asocjacja ze strukturą wirusa.
Białko Env jest syntetyzowane na rybosomach związanych z błonami siateczki śródplazmatycznej, następnie jest glikozylowane, cięte przez proteazę komórkową na gp120 i gp41, a następnie transportowane na powierzchnię komórki. W tym przypadku gp41 przenika przez błonę i wiąże się z domenami matrycowymi cząsteczki białka Gag związanej z wewnętrzną powierzchnią błony. To połączenie jest zachowane w dojrzałym wirionie.
Tak więc montaż cząstek wirusowych polega na agregacji białek prekursorowych i powiązanych cząsteczek RNA na błonie plazmatycznej komórki gospodarza, tworzeniu niedojrzałych wirionów i ich uwalnianiu przez pączkowanie z powierzchni komórki. Podczas pączkowania wirion otacza się błoną komórkową, w której osadzone są cząsteczki gp41 i gp120. Podczas pączkowania lub ewentualnie po uwolnieniu wirionów następuje ich dojrzewanie, które odbywa się za pomocą wirusowej proteazy i polega na proteolitycznym cięciu białek prekursorowych Pr55Gag i Prl60Gag-Pol na białka dojrzałego wirusa i ich asocjacji w określone kompleksy strukturalne. Wiodącą rolę w procesach morfogenezy wirusa odgrywa prekursorowe poliproteiny Pr55Gag, które organizują i składają niedojrzały wirion; proces jego dojrzewania jest uzupełniany przez specyficzną wirusową proteazę.
Przyczyny niedoboru odporności
Jedną z głównych przyczyn niedoboru odporności w zakażeniu HIV jest masowa śmierć komórek T-helperów. Występuje ona w wyniku następujących zdarzeń. Po pierwsze, komórki T-helperów zakażone wirusem giną z powodu apoptozy. Uważa się, że u pacjentów z AIDS replikacja wirusa, apoptoza i spadek liczby komórek T-helperów są ze sobą powiązane. Po drugie, komórki T-killery rozpoznają i niszczą komórki T zakażone wirusem lub niosące zaadsorbowane cząsteczki gpl20, a także komórki T-helperów zakażone wirusem i niezakażone wirusem, które tworzą symplasty (syncytium) składające się z kilkudziesięciu komórek (część z nich ginie w wyniku namnażania się w nich wirusów). W wyniku zniszczenia dużej liczby komórek pomocniczych T dochodzi do zmniejszenia ekspresji receptorów błonowych w limfocytach B do interleukiny-2, zaburzona zostaje synteza różnych interleukin (czynników wzrostu i różnicowania limfocytów B - IL-4, IL-5, IL-6 itp.), co powoduje zaburzenie funkcji układu T-killer. Aktywność układu dopełniacza i makrofagów jest tłumiona. Makrofagi i monocyty zakażone wirusem nie obumierają przez długi czas, ale nie są w stanie usunąć wirusa z organizmu. Wreszcie, ze względu na strukturalne i antygenowe podobieństwo gpl20 do receptorów niektórych komórek nabłonkowych organizmu (w tym receptorów trofoblastów pośredniczących w przeszczepieniu HIV), syntetyzowane są przeciwciała antyreceptorowe o szerokim spektrum działania. Takie przeciwciała są w stanie blokować różne receptory komórkowe i komplikować przebieg choroby zaburzeniami autoimmunologicznymi. Konsekwencją zakażenia HIV jest pokonanie wszystkich głównych ogniw układu odpornościowego. Tacy pacjenci stają się bezbronni wobec szerokiej gamy mikroorganizmów. Prowadzi to do rozwoju oportunistycznych zakażeń i nowotworów. U pacjentów zakażonych HIV wzrasta ryzyko rozwoju co najmniej trzech rodzajów nowotworów: mięsaków Kaposiego; raka (w tym raka skóry); chłoniaka B-komórkowego, który powstaje w wyniku złośliwej transformacji limfocytów B. Jednak HIV jest nie tylko limfocytotropowy, ale także neurotropowy. Wnika do komórek ośrodkowego układu nerwowego (astrocytów) zarówno poprzez endocytozę zależną od receptora, jak i poprzez fagocytozę zakażonych wirusem limfoblastów przez astrocyty. Gdy wirus wchodzi w interakcję z astrocytami, powstają również symplasty, które ułatwiają rozprzestrzenianie się patogenu kanałami międzykomórkowymi. Wirus może długo utrzymywać się w makrofagach i monocytach, dlatego pełnią one funkcję jego rezerwuaru i dystrybutorów w organizmie, będąc w stanie przenikać do wszystkich tkanek. Zakażone makrofagi odgrywają główną rolę we wprowadzaniu HIV do ośrodkowego układu nerwowego i jego uszkodzeniu. U 10% pacjentów pierwotne zespoły kliniczne są związane z uszkodzeniem ośrodkowego układu nerwowego i objawiają się demencją. Tak więc osoby zakażone HIV charakteryzują się 3 grupami chorób - zakażeniami oportunistycznymi,choroby nowotworowe i uszkodzenia ośrodkowego układu nerwowego.
Epidemiologia zakażeń HIV
Źródłem zakażenia HIV jest wyłącznie osoba chora lub nosiciel wirusa. Ludzki wirus niedoboru odporności (HIV) znajduje się we krwi, spermie, płynie szyjkowym; u matek karmiących – w mleku kobiecym. Zakażenie następuje drogą płciową, poprzez krew i jej preparaty, a także od matki do dziecka przed, w trakcie i po porodzie. Nie są znane przypadki zakażenia wirusem poprzez żywność, napoje i ukąszenia owadów.
Uzależnienie od narkotyków przyczynia się do rozprzestrzeniania się AIDS. Częstość występowania HIV rośnie z roku na rok. Według WHO, w latach 1980-2000, 58 milionów ludzi zostało zakażonych HIV. Tylko w 2000 roku, na całym świecie zakażonych było 5,3 miliona ludzi, a 3 miliony osób zmarło z powodu AIDS. Na dzień 1 stycznia 2004 roku w Rosji zarejestrowano 264 tysiące osób zakażonych HIV. Połowa osób zakażonych HIV umiera w ciągu 11-12 lat od momentu zakażenia. Na początku 2004 roku, na każde 100 tysięcy obywateli Rosji, około 180 żyło z diagnozą „zakażenia HIV”. Przewiduje się, że przy takim poziomie zachorowalności, łączna liczba osób zakażonych HIV w Rosji do 2012 roku wyniesie 2,5-3 miliony osób. Złożoność walki z zakażeniem HIV zależy od wielu przyczyn: po pierwsze, nie ma skutecznych metod jego leczenia i konkretnej profilaktyki; Po drugie, okres inkubacji zakażenia HIV może przekraczać 10 lat. Jego czas trwania zależy od momentu aktywacji limfocytu T i prowirusa DNA zawartego w jego chromosomie. Nadal nie jest jasne, czy każda osoba zarażona wirusem jest skazana na AIDS, czy też możliwe jest długotrwałe przenoszenie wirusa bez choroby (co wydaje się mało prawdopodobne). Wreszcie istnieje kilka wirusów niedoboru odporności ludzkiej (HIV-1, HIV-2), których różnice antygenowe zapobiegają powstawaniu odporności krzyżowej. Odkrycie wirusa niedoboru odporności małp (SIV) rzuciło światło na kwestię pochodzenia HIV. SIV jest podobny do HIV pod względem organizacji genomu, ale różni się znacząco sekwencją nukleotydową. HIV-2 zajmuje pozycję pośrednią między HIV-1 a SIV pod względem właściwości serologicznych i jest bliższy SIV pod względem sekwencji nukleotydowej. W związku z tym VM Zhdanov zasugerował, że wirusy HIV-1, HIV-2 i SIV pochodzą od wspólnego przodka. Według R. Gallo możliwe jest, że jeden z wirusów SIV w jakiś sposób przedostał się do organizmu człowieka, gdzie przeszedł serię mutacji, skutkujących powstaniem HIV-1, HIV-2 i jego innych form.
Objawy zakażenia wirusem HIV
Wirus niedoboru odporności ludzkiej ma pewne cechy, które w dużej mierze determinują patogenezę choroby. Wirus ma bardzo wysoką szybkość reprodukcji, uwarunkowaną jego elementami regulacyjnymi (do 5000 wirionów jest syntetyzowanych w ciągu 5 minut w fazie aktywnej). Ze względu na obecność białka fuzyjnego (gp41) wirus indukuje powstawanie rozległych struktur syncytialnych z powodu fuzji zakażonych i niezakażonych komórek pomocniczych T, co skutkuje ich masową śmiercią. Cząsteczki białka gpl20 utworzone w dużych ilościach swobodnie krążą we krwi i wiążą się z receptorami niezakażonych komórek pomocniczych T, w wyniku czego są również rozpoznawane i niszczone przez komórki zabójcze T. Wirus może rozprzestrzeniać się kanałami międzykomórkowymi z komórki do komórki, w takim przypadku staje się słabo dostępny dla przeciwciał.
Kryteria kliniczne zakażenia wirusem HIV
U dorosłych zakażenie HIV diagnozuje się, gdy występują co najmniej dwa poważne objawy w połączeniu z co najmniej jednym objawem mniej poważnym i przy braku innych znanych przyczyn niedoboru odporności (rak, wrodzony niedobór odporności, poważne wygłodzenie itp.). Poważne objawy obejmują:
- utrata masy ciała o 10% lub więcej;
- przedłużający się stan gorączkowy, okresowy lub stały;
- przewlekła biegunka.
Objawy drugorzędne: uporczywy kaszel, uogólnione zapalenie skóry, nawracający półpasiec, drożdżyca jamy ustnej i gardła, przewlekła opryszczka zwykła, uogólniona limfadenopatia. Rozpoznanie AIDS ustala się w przypadku obecności jedynie mięsaków Kaposiego, kryptokokowego zapalenia opon mózgowych, zapalenia płuc wywołanego przez pneumocystozę. Na obraz kliniczny choroby wpływa towarzysząca infekcja oportunistyczna.
Metody hodowli wirusa niedoboru odporności ludzkiej (HIV)
HIV-1 i HIV-2 można hodować w komórkach tylko jednego klonu limfocytów TCV4 - H9, uzyskanego z białaczkowych limfocytów TCV4. W tym celu można również stosować monowarstwowe kultury komórek astrocytów, w których HIV-1 dobrze się rozmnaża. Szympansy są podatne na HIV-1 wśród zwierząt.
Odporność wirusa w środowisku zewnętrznym jest niska. Ginie pod wpływem światła słonecznego i promieniowania UV, ulega zniszczeniu w temperaturze 80 °C w ciągu 30 minut, przy zastosowaniu powszechnie stosowanych środków dezynfekujących – w ciągu 20-30 minut. Do dezynfekcji materiału zawierającego wirusy konieczne jest stosowanie środków dezynfekujących o działaniu mykobakteryjnym, ponieważ są one skuteczne przeciwko mikroorganizmom o najwyższej odporności.
Diagnostyka laboratoryjna zakażenia wirusem HIV
Główną metodą diagnozowania nosicielstwa wirusa i zakażenia HIV jest immunoenzymatyczny test. Jednak ze względu na fakt, że gpl20 ma strukturalne i antygenowe podobieństwo do receptorów niektórych komórek ludzkich, w tym receptorów transportujących immunoglobuliny przez komórki nabłonkowe błon śluzowych, w organizmie mogą pojawić się przeciwciała związane z przeciwciałami przeciwko gpl20. W takim przypadku mogą wystąpić fałszywie dodatnie wyniki testu ELISA. Dlatego wszystkie dodatnio reagujące surowice badanych osób poddawane są dodatkowej analizie metodą immunoblottingu, czyli Western blotting. Metoda ta opiera się na identyfikacji badanych przeciwciał po ich elektroforetycznym rozdzieleniu i późniejszym badaniu przy użyciu znakowanych przeciwciał anty-gatunkowych. Metoda wirusologiczna jest rzadko stosowana ze względu na złożoność hodowli wirusa. Klon limfocytów H9 służy do uzyskania antygenów wirusowych - niezbędnych składników diagnostycznych systemów testowych. Metoda CPR pozwala na wykrycie wirusa na wczesnym etapie wiremii.
Leczenie zakażenia wirusem HIV
Konieczne jest znalezienie lub syntetyzowanie leków, które skutecznie hamują aktywność odwrotnej transkryptazy (revertase) lub proteazy wirusowej. Zapobiegałyby one tworzeniu prowirusa DNA i (lub) hamowałyby wewnątrzkomórkową reprodukcję wirusa. Nowoczesna strategia leczenia pacjentów zakażonych wirusem HIV opiera się na zasadzie skojarzonego stosowania leków hamujących proteazę wirusową (jeden z leków) i revertase (2 różne leki) - terapia łączona (potrójna). W Rosji do leczenia pacjentów zakażonych wirusem HIV zaleca się skojarzone stosowanie 2 krajowych leków: fosfazydu i kryksiwanu, które specyficznie hamują reprodukcję HIV na wczesnych i późnych etapach reprodukcji, zwłaszcza przy zmniejszonej aktywności azydotymidyny.
Problemem profilaktyki swoistej jest konieczność stworzenia szczepionki, która zapewniłaby wytworzenie skutecznej odporności komórkowej opartej na swoistych dla wirusa limfocytach cytotoksycznych bez znaczącej produkcji przeciwciał. Taką odporność zapewniają pomocnicy Thl. Możliwe, że przeciwciała, w tym neutralizujące wirusy, nie tylko są nieskuteczne w hamowaniu zakażenia HIV, ale w dużym stopniu hamują odporność komórkową. Dlatego szczepionka przeciwko HIV musi spełniać przede wszystkim dwa główne wymagania: a) być absolutnie bezpieczna i b) stymulować aktywność limfocytów T-cytotoksycznych. Badana jest skuteczność różnych wariantów szczepionki uzyskanych z zabitych (inaktywowanych) wirusów i z pojedynczych antygenów o wysokich właściwościach ochronnych. Takie antygeny mogą być albo izolowane z samych wirionów, albo syntetyzowane chemicznie. Zaproponowano szczepionkę stworzoną w oparciu o metody inżynierii genetycznej. Jest to rekombinowany wirus ospy, niosący geny HIV odpowiedzialne za syntezę antygenów o silnych właściwościach immunogennych. Kwestia skuteczności tych szczepionek wymaga znacznego czasu ze względu na długi okres inkubacji zakażenia HIV i dużą zmienność patogenu. Stworzenie wysoce skutecznej szczepionki przeciwko HIV jest pilnym, fundamentalnym problemem.

