Ekspert medyczny artykułu
Nowe publikacje
Przyczyny i patogeneza błonicy
Ostatnia recenzja: 04.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
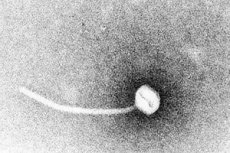
Błonica jest paradygmatem toksycznych chorób zakaźnych. W 1883 r. Klebs wykazał, że czynnikiem wywołującym błonicę jest Corynebacterium diphtheriae. Rok później Loeffler odkrył, że organizm można hodować tylko z jamy nosowo-gardłowej i zaproponował, że uszkodzenie narządów wewnętrznych było spowodowane rozpuszczalną toksyną. W 1888 r. Roux i Yersin wykazali, że u zwierząt wstrzykniętych jałowymi przesączami C. diphtheriae rozwijała się patologia narządów nieodróżnialna od tej występującej u ludzi na błonicy; wykazało to, że głównym czynnikiem wirulencji była silna egzotoksyna.
Błonica jest najczęściej infekcją górnych dróg oddechowych powodującą gorączkę, ból gardła i złe samopoczucie. Gruba, szarozielona błona fibrynowa, pseudomembrana, często tworzy się w miejscu(ach) zakażenia w wyniku połączonych efektów wzrostu bakterii, produkcji toksyn, martwicy tkanek leżących u podłoża i odpowiedzi immunologicznej gospodarza. Rozpoznanie, że uszkodzenie narządów układowych jest spowodowane działaniem toksyny błoniczej, doprowadziło do opracowania zarówno skutecznej terapii opartej na antytoksynie w leczeniu ostrej infekcji, jak i wysoce skutecznej szczepionki toksoidowej.
Chociaż szczepienie toksoidem uczyniło błonicę rzadką chorobą w obszarach, w których standardy zdrowia publicznego wymagają szczepień, ogniska błonicy nadal występują w grupach nieszczepionych i z obniżoną odpornością. Natomiast powszechne ogniska błonicy osiągające rozmiary epidemii miały miejsce w obszarach, w których zawieszono aktywne programy szczepień.
Inne rodzaje maczugowców
Oprócz C. diphtheriae, C. ulcerans i C. pseudotuberculosis, C. pseudodiphtheriticum i C. xerosis mogą czasami powodować zakażenia nosogardła i skóry. Te dwa ostatnie szczepy można rozpoznać po ich zdolności do wytwarzania pyrazynamidazy. W medycynie weterynaryjnej C. renale i C. kutscheri są ważnymi patogenami, wywołującymi odpowiednio odmiedniczkowe zapalenie nerek u bydła i utajone zakażenia u myszy.
Przyczyny
Czynnik wywołujący błonicę, Corynebacterium diphtheriae, jest cienkim, lekko zakrzywionym pręcikiem z maczugowatymi zgrubieniami na końcach, nieruchomym; nie tworzy zarodników, otoczek ani wici i jest Gram-dodatni.
Oprócz toksyny, maczugowce błonicze w trakcie procesów życiowych wytwarzają neuraminidazę, hialuronidazę, hemolizynę, czynniki martwicze i dyfuzyjne, które mogą powodować martwicę i upłynnienie głównej substancji tkanki łącznej.
Ze względu na zdolność wytwarzania toksyn, maczugowce błonicze dzielą się na toksynotwórcze i nietoksynotwórcze.
Toksyna błonicza jest silną egzotoksyną bakteryjną, która determinuje zarówno ogólne, jak i miejscowe objawy kliniczne choroby. Toksygenność jest uwarunkowana genetycznie. Nietoksyczne maczugowce błonicze nie powodują choroby.
Zgodnie z cechami kulturowymi i morfologicznymi wszystkie maczugowce błonicy dzielą się na 3 warianty: gravis, mitis, intermedius. Nie ma bezpośredniej zależności ciężkości choroby od wariantu maczugowców błonicy. Każdy wariant zawiera zarówno szczepy toksynotwórcze, jak i nietoksynotwórcze. Toksynotwórcze maczugowce wszystkich wariantów produkują identyczną toksynę. [ 1 ]
Struktura, klasyfikacja i typy antygenów
Corynebacterium diphtheriae to Gram-dodatnia, nieruchoma, maczugowata pałeczka. Szczepy rosnące w tkankach lub starszych kulturach in vitro zawierają drobne plamki w ścianach komórkowych, które umożliwiają odbarwienie podczas barwienia metodą Grama i powodują zmienną reakcję Grama. Starsze kultury często zawierają metachromatyczne granulki (polimetafosforan), które barwią się na niebiesko-fioletowo błękitem metylenowym. Cukry ścian komórkowych obejmują arabinozę, galaktozę i mannozę. Ponadto można wyizolować toksyczny 6,6'-ester trehalozy, zawierający kwasy korynemykolowy i korynemykolowy w stężeniach ekwimolarnych. Rozpoznaje się trzy odrębne typy kultur: mitis, intermedius, gravis.
Większość szczepów wymaga kwasów nikotynowego i pantotenowego do wzrostu; niektóre wymagają również tiaminy, biotyny lub kwasu pimelinowego. Aby uzyskać optymalną produkcję toksyny błoniczej, podłoże musi zostać uzupełnione aminokwasami i musi zostać odstawione.
Już w 1887 roku Loeffler opisał izolację awirulentnych (nietoksygennych) C. diphtheriae, które były nieodróżnialne od wirulentnych (toksygennych) szczepów izolowanych od pacjentów u zdrowych osób. Obecnie wiadomo, że awirulentne szczepy C. diphtheriae mogą zostać przekształcone w fenotyp wirulentny po zakażeniu i lizogenizacji przez jednego z wielu odrębnych maczugowców niosących gen strukturalny toksyny błoniczej, tox. Lizogenna konwersja fenotypu awirulentnego w wirulentny może wystąpić zarówno in situ, jak i in vitro. Gen strukturalny toksyny błoniczej nie jest niezbędny ani dla maczugowców, ani dla C. diphtheriae. Pomimo tej obserwacji nie zaobserwowano dryfu genetycznego toksyny błoniczej.
Patogeneza
Punktami wejścia zakażenia są błony śluzowe gardła, nosa, krtani, rzadziej błony śluzowe oczu i narządów płciowych, a także uszkodzona skóra, rany lub oparzenia, pieluszkowe zapalenie skóry, niezagojona rana pępkowa. W punkcie wejścia namnaża się maczugowiec błonicy i wydziela egzotoksynę.
Wysięk bogaty w fibrynogen jest wydzielany i przekształcany w fibrynę pod wpływem trombokinazy uwalnianej podczas martwicy komórek nabłonkowych. Tworzy się błonka włóknista - charakterystyczny objaw błonicy.
Bezobjawowe nosicielstwo nosogardła jest powszechne w regionach endemicznych błonicy. U podatnych osób szczepy toksynogenne powodują chorobę poprzez replikację i wydzielanie toksyny błoniczej w nosogardzieli lub zmianach skórnych. Zmiana błonicza jest często pokryta pseudobłoną składającą się z fibryny, bakterii i komórek zapalnych. Toksynę błoniczą można proteolitycznie rozszczepić na dwa fragmenty: fragment N-końcowy A (domena katalityczna) i fragment B (domena transbłonowa i wiążąca receptor). Fragment A katalizuje zależną od NAD+ ADP-rybozylację czynnika elongacji 2, hamując w ten sposób syntezę białka w komórkach eukariotycznych. Fragment B wiąże się z receptorem powierzchniowym komórki i ułatwia dostarczenie fragmentu A do cytozolu.
Odporność ochronna obejmuje odpowiedź przeciwciał na toksynę błoniczą po wystąpieniu objawów klinicznych choroby lub na toksynę błoniczą (toksynę inaktywowaną formaldehydem) po szczepieniu.
Kolonizacja
Niewiele wiadomo o czynnikach, które pośredniczą w kolonizacji C. diphtheriae. Jednak jest jasne, że czynniki inne niż produkcja toksyny błoniczej przyczyniają się do wirulencji. Badania epidemiologiczne wykazały, że dany lizotyp może przetrwać w populacji przez długi czas. Później może zostać zastąpiony przez inny lizotyp. Pojawienie się i późniejsza dominacja nowego lizotypu w populacji jest prawdopodobnie związana z jego zdolnością do kolonizacji i skutecznej konkurencji w jego segmencie niszy ekologicznej nosogardła. Corynebacterium diphtheriae może wytwarzać neuraminidazę, która rozszczepia kwas sialowy na powierzchni komórki na jego składniki pirogronian i kwas N-acetyloneuraminowy. Czynnik rdzeniowy (6,6'-di-O-mycoloyl-α, α'-D-trehaloza) jest składnikiem powierzchniowym C. diphtheriae, ale jego rola w kolonizacji gospodarza ludzkiego jest niejasna.
Produkcja toksyn błoniczych
Gen strukturalny toksyny błoniczej, tox, należy do rodziny blisko spokrewnionych maczugowców, z których β-fag jest najlepiej zbadany. Regulacja ekspresji toksyny błoniczej jest pośredniczona przez represor aktywowany żelazem, DtxR, który jest kodowany przez genom C. diphtheriae. Ekspresja toksyny zależy od stanu fizjologicznego C. diphtheriae. W warunkach, w których żelazo staje się substratem ograniczającym szybkość wzrostu, żelazo dysocjuje od DtxR, gen toxicodendron zostaje aktywowany, a toksyna błonicza jest syntetyzowana i wydzielana do pożywki hodowlanej z maksymalną szybkością.
Toksyna błonicza jest niezwykle silna; dla podatnych gatunków (np. ludzi, małp, królików, świnek morskich) dawka śmiertelna wynosi zaledwie 100–150 ng/kg masy ciała. Toksyna błonicza składa się z pojedynczego łańcucha polipeptydowego składającego się z 535 aminokwasów. Analiza biochemiczna, genetyczna i rentgenowska struktury wykazuje, że toksyna składa się z trzech domen strukturalnych/funkcjonalnych:
- N-końcowa ADP-rybozylotransferaza (domena katalityczna);
- region ułatwiający transport domeny katalitycznej przez błonę komórkową (domena transbłonowa);
- domena wiążąca receptor komórki eukariotycznej.
Po łagodnym trawieniu trypsyną i redukcji w warunkach denaturujących toksynę błoniczą można specyficznie rozszczepić w jej pętli wrażliwej na proteazę na dwa fragmenty polipeptydowe (A i B). Fragment A jest N-końcowym 21 kDa składnikiem toksyny i zawiera miejsce katalityczne dla ADP-rybozylacji czynnika elongacji 2 (EF-2).
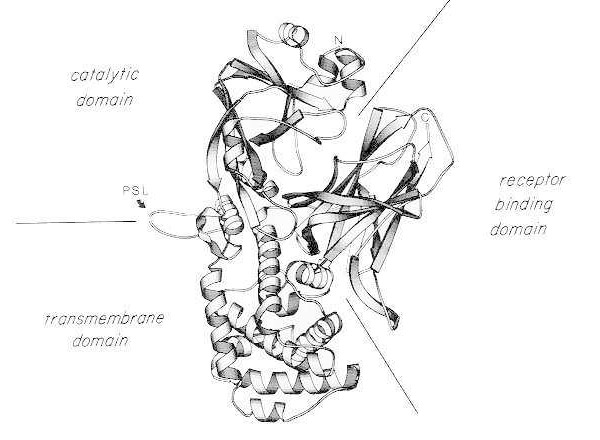
Diagram wstęgowy struktury krystalicznej rentgenowskiej monomerycznej rodzimej toksyny błoniczej. (zmodyfikowano na podstawie Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Pokazano względne położenia domen katalitycznej, transbłonowej i wiążącej receptor. Nienaruszoną toksynę można rozszczepić za pomocą proteaz podobnych do trypsyny w Arg190, Arg192 i/lub Arg193, które znajdują się w pętli wrażliwej na proteazę (PSL). Po redukcji mostka disiarczkowego między Cys186 i Cys201 toksynę można rozdzielić na fragmenty A i B. Pokazano koniec aminowy (N) i koniec karboksylowy (C) nienaruszonej toksyny. Diagram paskowy utworzono przy użyciu programu MOLESCRIPT.
Fragment C-końcowy, fragment B, zawiera domenę transbłonową i domenę wiążącą receptor toksyny.
Zatrucie pojedynczej komórki eukariotycznej toksyną błoniczą obejmuje co najmniej cztery odrębne etapy:
- wiązanie toksyny z receptorem na powierzchni komórki;
- skupienie naładowanych receptorów w powlekanych dołkach i internalizacja toksyny poprzez endocytozę zależną od receptora; po zakwaszeniu pęcherzyka endocytarnego przez związaną z błoną pompę protonową napędzaną ATP,
- wprowadzenie domeny transbłonowej do błony i ułatwienie dostarczenia domeny katalitycznej do cytozolu oraz
- ADP-rybozylacja EF-2 powodująca nieodwracalne zahamowanie syntezy białka.
Wykazano, że pojedyncza cząsteczka domeny katalitycznej dostarczona do cytozolu wystarczy, aby spowodować śmierć komórki.
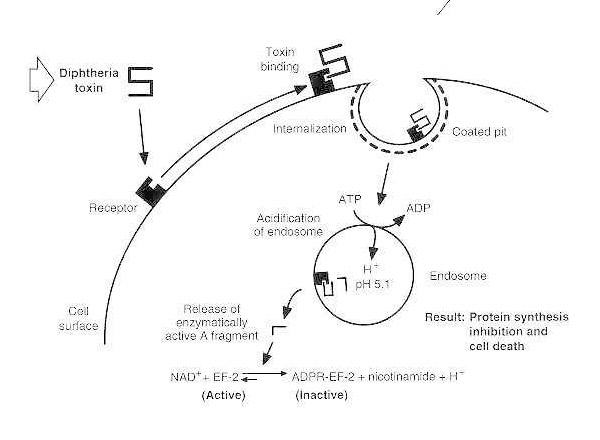
Schematyczny diagram zatrucia błonicą podatnej komórki eukariotycznej.
Toksyna wiąże się z receptorem na powierzchni komórki i jest internalizowana poprzez endocytozę zależną od receptora; po zakwaszeniu endosomu domena transbłonowa zostaje wprowadzona do błony pęcherzyka, a domena katalityczna zostaje dostarczona do cytozolu, co prowadzi do zahamowania syntezy białka i śmierci komórki.
Epidemiologia
Przed masowym szczepieniem populacji USA toksoidem błoniczym błonica była zwykle chorobą wieku dziecięcego. Godnym uwagi aspektem masowego szczepienia toksoidem błoniczym jest to, że wraz ze wzrostem odsetka populacji z ochronnym poziomem odporności na antytoksynę (≥ 0,01 IU/ml) zmniejsza się częstość izolacji szczepów toksynotwórczych z populacji. Obecnie w Stanach Zjednoczonych, gdzie kliniczna błonica prawie całkowicie zanikła, izolacja szczepów toksynotwórczych C. diphtheriae jest rzadka. Ponieważ subkliniczne zakażenie nie stanowi już źródła narażenia na antygen błoniczy, a odporność na antytoksynę, jeśli nie zostanie wzmocniona, słabnie, duży odsetek dorosłych (30 do 60%) ma poziom antytoksyny poniżej poziomu ochronnego i jest narażony na ryzyko. W Stanach Zjednoczonych, Europie i Europie Wschodniej ostatnie wybuchy błonicy wystąpiły głównie wśród osób nadużywających alkoholu i/lub narkotyków. W tej grupie nosiciele toksynotwórczych C. diphtheriae mają umiarkowanie wysoki poziom odporności antytoksycznej. Niedawne załamanie się środków ochrony zdrowia publicznego w Rosji spowodowało, że błonica stała się epidemią. Do końca 1994 r. w Rosji odnotowano ponad 80 000 przypadków i ponad 2000 zgonów.
Ogniskowe ogniska błonicy są prawie zawsze związane z nosicielem odpornościowym, który powrócił z regionu, w którym błonica jest endemiczna. Rzeczywiście, ostatnie ogniska klinicznej błonicy w Stanach Zjednoczonych i Europie były związane z podróżnymi powracającymi z Rosji i Europy Wschodniej. Toksyczne szczepy C. diphtheriae są przenoszone bezpośrednio z osoby na osobę za pomocą unoszących się w powietrzu kropelek. Wiadomo, że szczepy toksyczne mogą bezpośrednio kolonizować jamę nosowo-gardłową. Ponadto gen toksyczny może być rozprzestrzeniany pośrednio przez uwalnianie toksycznego maczugowatego bakteriofaga i lizogenną transformację nietoksycznego autochtonicznego C. diphtheriae in situ. [ 5 ]
Oprócz określania biotypu i lizotypu izolatów C. diphtheriae, techniki biologii molekularnej mogą być teraz wykorzystywane do badania ognisk błonicy. Wzory trawienia restrykcyjnymi endonukleazami chromosomalnego DNA C. diphtheriae zostały wykorzystane do badania ognisk klinicznych, podobnie jak klonowane sekwencje insercji Corynebacterium jako sondy genetycznej.
Test Schicka był stosowany od wielu lat w celu oceny odporności na toksynę błoniczą, chociaż w wielu obszarach został zastąpiony testem serologicznym na obecność swoistych przeciwciał przeciwko toksynie błoniczej. W teście Schicka niewielka ilość toksyny błoniczej (około 0,8 ng w 0,2 ml) jest wstrzykiwana śródskórnie w przedramię (miejsce testowe), a 0,0124 μg toksyny błoniczej w 0,2 ml jest wstrzykiwane śródskórnie w miejsce kontrolne. Odczyty są wykonywane po 48 i 96 godzinach. Nieswoiste reakcje skórne zwykle osiągają szczyt po 48 godzinach. Po 96 godzinach reakcja rumieniowa z pewną możliwą martwicą w miejscu testowym wskazuje na niewystarczającą odporność antytoksyczną, aby zneutralizować toksynę (≤ 0,03 IU/ml). Stan zapalny w obszarze testowym i kontrolnym po 48 godzinach świadczy o reakcji nadwrażliwości na preparat antygenowy.
Formularze
Corynebacterium diphtheriae infekuje nosogardło lub skórę. Szczepy toksynotwórcze wytwarzają silną egzotoksynę, która może powodować błonicę. Objawy błonicy obejmują zapalenie gardła, gorączkę i obrzęk szyi lub okolicy wokół zmiany skórnej. Zmiany błonicze są pokryte błoną rzekomą. Toksyna rozprzestrzenia się przez krwiobieg do odległych narządów i może powodować paraliż i zastoinową niewydolność serca. [ 6 ]
Istnieją dwa rodzaje błonicy klinicznej: nosogardłowa i skórna. Objawy błonicy gardła wahają się od łagodnego zapalenia gardła do niedotlenienia z powodu niedrożności dróg oddechowych przez błonę rzekomą. Zajęcie węzłów chłonnych szyjnych może powodować poważny obrzęk szyi (błonica byczej szyi), a u pacjenta może wystąpić gorączka (≥ 103°F). Zmiany skórne w błonicy skórnej są zwykle pokryte szarobrązową błoną rzekomą. Zagrażające życiu powikłania układowe, głównie utrata funkcji motorycznych (np. trudności z połykaniem) i zastoinowa niewydolność serca, mogą rozwinąć się w wyniku działania toksyny błoniczej na obwodowe neurony ruchowe i mięsień sercowy.
Kontrola
Kontrola błonicy zależy od odpowiedniej immunizacji toksoidem błoniczym: toksyną błoniczą inaktywowaną przez formaldehyd, która pozostaje nienaruszona antygenowo. Toksoid przygotowuje się przez inkubację toksyny błoniczej z formaldehydem w temperaturze 37°C w warunkach zasadowych. Uodpornienie na błonicę powinno rozpocząć się w drugim miesiącu życia serią trzech dawek podstawowych w odstępach 4-8 tygodni, a następnie czwartą dawką około 1 rok po ostatniej dawce podstawowej. Toksoid błoniczy jest szeroko stosowany jako składnik szczepionki przeciwko błonicy, krztuścowi i tężcowi (DPT). Badania epidemiologiczne wykazały, że immunizacja przeciwko błonicy jest skuteczna w około 97%. Chociaż masowe szczepienia przeciwko błonicy są praktykowane w Stanach Zjednoczonych i Europie, a wskaźniki szczepień dzieci są odpowiednie, znaczna część populacji dorosłych może mieć miana przeciwciał poniżej poziomu ochronnego. Dorośli powinni być ponownie szczepieni toksoidem błoniczym co 10 lat. Rzeczywiście, szczepionka przypominająca toksoidem błoniczym i tężcowym powinna być podawana podróżnym do obszarów o wysokim wskaźniku endemicznej błonicy (Ameryka Środkowa i Południowa, Afryka, Azja, Rosja i Europa Wschodnia). W ostatnich latach stosowanie wysoko oczyszczonych preparatów toksoidowych do szczepień zminimalizowało sporadyczne ciężkie reakcje nadwrażliwości. szczepionka przypominająca toksoidem błoniczym i tężcowym powinna być podawana podróżnym do obszarów o wysokim wskaźniku endemicznej błonicy (Ameryka Środkowa i Południowa, Afryka, Azja, Rosja i Europa Wschodnia). W ostatnich latach stosowanie wysoko oczyszczonych preparatów toksoidowych do szczepień zminimalizowało sporadyczne ciężkie reakcje nadwrażliwości. Szczepionka przypominająca toksoidem błoniczym i tężcowym powinna być podawana podróżnym do obszarów o wysokim wskaźniku endemicznej błonicy (Ameryka Środkowa i Południowa, Afryka, Azja, Rosja i Europa Wschodnia). W ostatnich latach stosowanie wysoko oczyszczonych preparatów toksoidowych w immunizacjach pozwoliło zminimalizować sporadyczne występowanie ciężkich reakcji nadwrażliwości.
Chociaż antybiotyki (takie jak penicylina i erytromycyna) są stosowane w ramach leczenia pacjentów z błonicą, szybka bierna immunizacja antytoksyną błoniczą jest najskuteczniejsza w zmniejszaniu śmiertelności przypadków. Długi okres półtrwania specyficznej antytoksyny we krwi jest ważnym czynnikiem zapewniającym skuteczną neutralizację toksyny błoniczej; jednak aby była skuteczna, antytoksyna musi zareagować z toksyną, zanim będzie mogła dostać się do komórki.
Przeprojektowanie toksyny błoniczej w celu opracowania cytotoksyn specyficznych dla receptorów eukariotycznych
Inżynieria białek to nowa i szybko rozwijająca się dziedzina biologii molekularnej; łączy ona metody rekombinacji DNA i syntezę DNA w fazie stałej w celu projektowania i konstruowania genów chimerycznych, których produkty mają unikalne właściwości. Badania zależności struktura-funkcja toksyny błoniczej wyraźnie wykazały, że toksyna ta jest białkiem trójdomenowym: katalitycznym, transbłonowym i receptorowym. Możliwe było genetyczne zastąpienie natywnej domeny wiążącej receptor toksyny błoniczej różnymi hormonami polipeptydowymi i cytokinami (np. hormonem stymulującym α-melanocyty [α-MSH], interleukiną (IL) 2, IL-4, IL-6, IL-7, naskórkowym czynnikiem wzrostu). Powstałe białka chimeryczne lub toksyny fuzyjne łączą specyficzność wiązania receptora cytokiny z domenami transbłonowymi i katalitycznymi toksyny. W każdym przypadku wykazano, że toksyny fuzyjne selektywnie zatruwają tylko te komórki, które noszą odpowiedni receptor docelowy. Pierwsza z tych genetycznie zmodyfikowanych toksyn fuzyjnych, DAB 389IL-2, jest obecnie oceniana w badaniach klinicznych na ludziach w leczeniu opornych chłoniaków i chorób autoimmunologicznych, w których komórki z receptorami IL-2 o wysokim powinowactwie odgrywają ważną rolę w patogenezie. [ 7 ] Wykazano, że podawanie DAB 389 IL-2 jest bezpieczne, dobrze tolerowane i zdolne do wywołania trwałej remisji choroby bez poważnych skutków ubocznych. Jest prawdopodobne, że toksyny fuzyjne na bazie toksyny błoniczej staną się ważnymi nowymi środkami biologicznymi w leczeniu określonych nowotworów lub chorób, w których można celować w określone receptory powierzchniowe komórek.


 [
[