Ekspert medyczny artykułu
Nowe publikacje
Leki
Leki zapobiegające zakrzepicy i poprawiające reologię krwi
Ostatnia recenzja: 07.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
W zapobieganiu powstawaniu licznych mikroskrzepów w przebiegu wstrząsu oraz ich niszczeniu można stosować różne podejścia farmakologiczne, wykorzystujące leki zapobiegające tworzeniu się skrzepów i poprawiające reologię krwi:
- eliminacja zaburzeń hemodynamicznych i mikrokrążenia układowego za pomocą środków wazoaktywnych i inotropowych;
- działania mające na celu poprawę reologii krwi przy zastosowaniu racjonalnej terapii infuzyjnej oraz leków przywracających elastyczność błon erytrocytów (trental lub pentoksyfilina);
- zapobieganie agregacji płytek krwi i tworzeniu się początkowych „białych” skrzepów w małych naczyniach tętniczych, a następnie inicjacja kaskady krzepnięcia;
- hamowanie powstawania zakrzepów po aktywacji kaskady krzepnięcia krwi;
- aktywacja fibrynolizy w celu rozpuszczenia nowo powstałych skrzepów krwi (fibrynolizyna, streptokinaza, streptodekaza, urokinaza itp.) lub przeciwnie – hamowanie fibrynolizy, gdy jest ona uogólniona u niektórych chorych ze wstrząsem pourazowym i posocznicą (kwas aminokapronowy, amben, contrical itp.).
Większość wymienionych podejść jest tradycyjna, dobrze rozwinięta w praktyce leczenia wstrząsu, ma własne wskazania hemoreologiczne i jest wyszczególniona w odpowiednich rozdziałach. Dlatego w tej sekcji wskazane jest skupienie się na rozważaniach nad ogólnym podejściem do zapobiegania powstawaniu zakrzepów we wstrząsie przy użyciu środków farmakologicznych, które wpływają na profazę krzepnięcia krwi. To właśnie ten poziom zapobiegania powikłaniom krzepnięcia - powstawaniu, powstawaniu i wzroście „białych skrzepów tętniczych” - przyciąga największą uwagę badaczy.
Różnorodne i często wielokierunkowe zaburzenia krzepnięcia krwi z pogorszeniem jej reologii są charakterystyczne dla różnych typów wstrząsu. Najbardziej charakterystyczne dla wstrząsu septycznego, endotoksyny, oparzeniowego, pourazowego i krwotocznego jest powstawanie licznych mikrozakrzepów w najmniejszych naczyniach, wywołanych zaburzeniami hemodynamiki układowej, skurczem naczyń i zaburzeniami mikrokrążenia, zagęszczeniem krwi, osadem, zmniejszoną elastycznością błon erytrocytów, a także licznymi czynnikami ogólnymi i miejscowymi (autokoidy) inicjującymi lokalne zmiany w hemostazie krzepnięcia i włączenie profazy krzepnięcia krwi.
W sposób schematyczny (skrócony) przedstawiono początkowy etap hemokoagulacji i mechanizm miejscowej homeostazy hemokoagulacji.
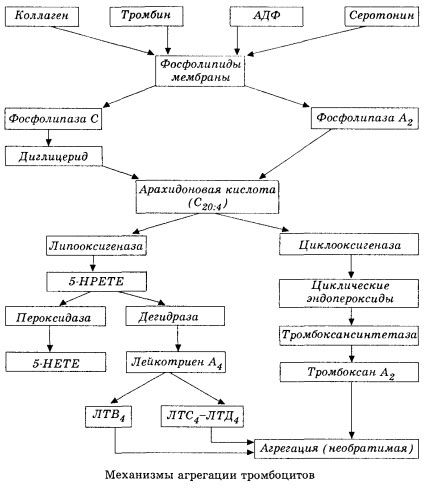
Rozpoczyna się od aktywacji fosfolipazy błonowej A2 w wyniku oddziaływania kombinacji czynników uszkadzających (bezpośrednie uszkodzenie błony, niedotlenienie, peroksydacja lipidów, oddziaływanie endogennych czynników chemicznych itp.). W wyniku rozpadu fosfolipidów błonowych uwalniane są nieestryfikowane długołańcuchowe kwasy tłuszczowe, z których kwas arachidonowy jest najważniejszy jako początkowy substrat. Jego transformacja (kaskada kwasu arachidonowego) zachodzi poprzez szlaki lipooksygenazy (synteza leukotrienów) i cyklooksygenazy (synteza prostaglandyn, tromboksanów, prostacykliny).
Powstałe leukotrieny (B4, C4, E4, D4 itd.) - substancje o niezwykle wysokiej aktywności biologicznej, do których zalicza się wolno reagującą substancję anafilaksji - mają ogromne znaczenie w inicjacji lokalnych reakcji naczyniowych, zapalnych i immunologicznych, w tym procesów autoimmunologicznych. Leukotrieny powodują zaburzenia mikrokrążenia, zwiększoną krzepliwość krwi, uwalnianie autolitycznych enzymów lizosomalnych i uwalnianie do krwi czynnika hamującego kurczliwość mięśnia sercowego i skurcz oskrzeli.
Ze względu na zdolność wywoływania skurczów mięśni gładkich, leukotrieny znacząco wpływają na hemodynamikę układową, naczynia wieńcowe i mięsień sercowy, wywierając silny efekt zwężający naczynia wieńcowe i ujemny efekt inotropowy, któremu towarzyszy spadek rzutu serca i odgrywa ważną rolę w rozwoju niedociśnienia.
Zmniejszony rzut serca i hipotensyjna odpowiedź na leukotrieny są związane z osłabieniem mięśnia sercowego i ograniczeniem powrotu żylnego do serca. Istotne znaczenie w ograniczaniu powrotu żylnego ma zdolność leukotrienów do zwiększania przepuszczalności ściany naczyniowej i powodowania wynaczynienia osocza. Leukotrieny są uważane za ważne w patogenezie zawału mięśnia sercowego.
W przypadku wstrząsu anafilaktycznego i septycznego (endotoksynowego) ich rola najwyraźniej wzrasta jeszcze bardziej, o czym świadczy zdolność leukotrienów do gromadzenia się w znacznych ilościach w osoczu podczas reakcji alergicznych i powodowania zmian w przepływie krwi w układzie, charakterystycznych dla wstrząsu anafilaktycznego, a także ochronne działanie blokerów receptorów leukotrienowych i inhibitorów lipooksygenazy. Rozwój selektywnych blokerów receptorów leukotrienowych jest prowadzony dość intensywnie i stanowi obiecujący kierunek nauki. W tej dziedzinie osiągnięto już pewne sukcesy, a skuteczność takich blokerów w niedokrwieniu mięśnia sercowego, wstrząsie endotoksynowym i krwotocznym została potwierdzona eksperymentalnie. Jednak prawdopodobnie minie jeszcze kilka lat, zanim ten kierunek zostanie wdrożony klinicznie.
Jeśli w naczyniach żylnych zakrzepy tworzą się przy równym udziale trombocytów i czynników krzepnięcia osocza, to w tętnicach trombocyty są głównymi inicjatorami procesu. Zawierają ADP, Ca2+, serotoninę, fosfolipidy, enzymy syntezy prostaglandyn i tromboksanu, trombosteninę (podobnie jak mięśniowa aktomiozyna zapewnia kurczliwość tych komórek), trombogenny czynnik wzrostu nabłonka i komórek mięśniowych ściany naczyniowej oraz szereg innych substancji. Humoralna regulacja funkcji trombocytów odbywa się za pośrednictwem wyspecjalizowanych receptorów ich błon (adrenoreceptory alfa2 i beta2, receptory histaminy i serotoniny, acetylocholiny, tromboksanu, adenozyny i szereg innych). Szczególną właściwością trombocytów jest wysokie powinowactwo do kolagenu i innych podśródbłonkowych elementów ściany naczyniowej, do powierzchni niezwilżalnych i naładowanych ujemnie. Ta właściwość zapewnia trombocytom wyjątkową zdolność do przylegania (przyklejania się) do odcinka naczynia z uszkodzonym śródbłonkiem, który ma duże szanse na uszkodzenie podczas wstrząsu. W tym przypadku trombocyty rozprzestrzeniają się i uwalniają pseudopodia, które mogą przylegać do siebie i do ściany naczynia. Przepuszczalność błony wzrasta, a ADP, serotonina, tromboksan i niektóre czynniki krzepnięcia zaadsorbowane na powierzchni trombocytu są uwalniane z trombocytów. Substancje te oddziałują z odpowiednimi receptorami na błonie i przy udziale jonów wapnia powodują agregację (początkowo odwracalną). Proces staje się samopodtrzymujący, co ułatwiają humoralne czynniki regulacyjne; inne czynniki, przeciwnie, mogą go zatrzymać, a nawet odwrócić, powodując dezagregację.
Przy przewadze wpływów i warunków skrzepowotwórczych, fazy adhezji i odwracalnej agregacji zostają zastąpione przez trzecią fazę - nieodwracalną agregację, która odbywa się przy udziale trombosteniny i prowadzi do zwężenia skrzepu; reakcja wzmocnienia agreganta i zwężenia zachodzi również przy udziale Ca+, ATP i prowadzi do powstania białego skrzepu.
Szlak cyklooksygenazy konwersji kwasu arachidonowego w płytkach krwi, komórkach śródbłonka naczyniowego i innych tkankach zapewnia lokalną (okres półtrwania metabolitów jest bardzo krótki) homeostazę krzepnięcia, ponieważ podczas tego metabolizmu powstają silne substancje pro- i antyagregacyjne. Głównym czynnikiem aktywującym agregację płytek krwi w łańcuchu reakcji cyklooksygenazy jest tromboksan A2, a jego nie mniej silnym antagonistą jest prostacyklina, produkowana przez komórki śródbłonka i, w mniejszym stopniu, prostaglandyny serii E i G. Wreszcie, na agregację płytek krwi silnie wpływają dodatkowe lokalne i systemowe czynniki humoralne.
Aktywatory i inhibitory agregacji płytek krwi
Inicjatory i aktywatory agregacji płytek krwi |
Inhibitory agregacji płytek krwi |
Kolagen |
- |
ADP |
Adenozyna i jej stabilizatory |
Noradrenalina (poprzez receptory alfa2) |
Środki blokujące receptory alfa-adrenergiczne |
Serotonina |
Środki przeciwserotoninowe |
Histamina |
Leki przeciwhistaminowe |
Trombina |
Heparyna |
Ca2+ |
Antagoniści Ca2+ |
CGMP - jego induktory (acetylocholina?) i stabilizatory |
CAM - jego induktory (poprzez receptory beta-adrenergiczne) i stabilizatory (inhibitory fosfodiesterazy) |
Kwas arachidonowy |
Dekstrany, albumina |
Tromboksan A2 |
Prostacyklina I2 |
Interwencje farmakologiczne w początkowej fazie tworzenia się zakrzepu w przebiegu wstrząsu i ostrych procesów niedokrwiennych serca i mózgu sugerują następującą możliwość:
- hamowanie początkowych reakcji (całkowitych i częściowych) kaskady kwasu arachidonowego;
- hamowanie określonej reakcji syntezy tromboksanu;
- blokada receptorów leukotrienów i tromboksanów w płytkach krwi, mięśniach gładkich i innych komórkach;
- stosowanie substancji modulujących agregację płytek krwi, czyli osłabiających w inny sposób reakcję płytek na działanie czynników inicjujących (kolagen, tromboksan A2, leukotrieny itp.).
Wdrożenie wymienionych sposobów korekcji zaburzeń właściwości reologicznych krwi zapewnia rozwiązanie głównego zadania taktycznego: ochronę receptorów agregacji i adhezji płytek krwi przed działaniem aktywatorów lub tłumienie wewnątrzkomórkowych mechanizmów syntezy tych receptorów. Hamowanie początkowych reakcji kaskady kwasu arachidonowego można osiągnąć poprzez ochronę receptorów płytek krwi, reagujących na aktywatory polimerowe, przy użyciu niskocząsteczkowych dekstranów, których cząsteczki konkurują z fibryną, kolagenem, zagregowaną immunoglobuliną (IgE) i składnikami układu dopełniacza.
Maskując receptory na błonie płytek krwi i konkurując z dużymi rozproszonymi białkami na powierzchni erytrocytów, niskocząsteczkowe dekstrany wypierają je i niszczą mostki między komórkami. Dzieje się tak, ponieważ dekstrany, otaczające śródbłonek naczyniowy i powierzchnię elementów komórkowych krwi, zwiększają swój ładunek ujemny, wzmacniając w ten sposób właściwości antyagregacyjne.
Dekstrany
Dekstrany o małej masie cząsteczkowej redukują agregację płytek krwi wywołaną kolagenem i ADP, a także aktywujące działanie trombiny na płytki krwi, hamują wzrost początkowego białego skrzepu płytkowego, poprawiają przepływ krwi, redukują pooperacyjny wzrost zawartości fibrynogenu w osoczu oraz zmieniają strukturę i stabilność fibryny.
Dożylne wlewy dekstranów w urazach i wstrząsach nie tylko zmniejszają agregację i przyleganie płytek krwi, ale także mobilizują endogenną heparynę, tym samym promując tworzenie luźnego i słabo odciąganego skrzepu krwi, który jest łatwo lizowany przez fibrynolityki. Aktywność antytrombinowa niskocząsteczkowych dekstranów jest związana z ich specyficznym wpływem na strukturę i funkcję czynnika krzepnięcia krwi VIII. Czynnik VIII (globulina antyhemofilowa), duża cząsteczka o złożonej strukturze i funkcji, bierze udział w agregacji płytek krwi i stabilności powstałego skrzepu. Dekstrany zakłócają działanie czynnika VIII, tym samym spowalniając agregację płytek krwi i zmniejszając stabilność skrzepu.
Dekstrany o małej masie cząsteczkowej nie są prawdziwymi antykoagulantami, a ich działanie korygujące w zaburzeniach hemoreologicznych wiąże się głównie z hemodylucją, uzupełnieniem objętości osocza krążącego i poprawą przepływu krwi w układzie mikrokrążenia.
Zdolność dekstranów do poprawy przepływu krwi w zaburzeniach hemodynamicznych (wstrząs, utrata krwi) wynika ze złożonego zespołu czynników. Wystąpienie wysokiego przejściowego stężenia polimeru we krwi nie tylko prowadzi do „bezpośredniej hemodylucji”, ale także stwarza warunki do przepływu płynu do krwiobiegu z przestrzeni śródmiąższowej i późniejszego zrównoważenia osmotycznego działania dekstranu. W wyniku hemodylucji zmniejsza się lepkość krwi, zwiększa się napływ żylny do serca i zwiększa się rzut serca. Oprócz tych efektów dekstrany tworzą kompleksy z fibrynogenem i mają działanie antylipemijne.
W ten sposób działanie antyagregacyjne i efekty hemodynamiczne dekstranów niskocząsteczkowych pomagają zmniejszyć lepkość krwi, co jest szczególnie ważne przy niskich szybkościach ścinania. Dezagregacja komórek krwi poprawia przepływ krwi i mikrokrążenie systemowe, zwłaszcza w jego części żylnej, gdzie gradienty prędkości są najniższe. Zastosowanie roztworów dekstranu niskocząsteczkowego w różnych typach wstrząsu, podczas leczenia operacyjnego urazów i ich następstw, a następnie w okresie pooperacyjnym pomaga zapobiegać hiperkoagulacji i zmniejsza prawdopodobieństwo procesów zakrzepowych i zatorów.
Należy jednak zauważyć, że w niektórych przypadkach wlewom roztworów dekstranu towarzyszą reakcje anafilaktyczne i alergiczne (niebezpieczne w przypadku uczulenia i wstrząsu anafilaktycznego). Wynika to z faktu, że dekstrany, które mają dużą masę cząsteczkową i wiele łańcuchów bocznych, mogą działać jako antygen. Dlatego w celu ustalenia indywidualnej wrażliwości zaleca się wstępne podanie dożylne do 20 ml roztworu dekstranu niskocząsteczkowego jako haptenu (roztwór 15%, masa cząsteczkowa 1000) i przeprowadzenie wlewów substytutu osocza przed wprowadzeniem znieczulenia.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inhibitory trombiny
Farmakologiczną ochronę receptorów płytek krwi oddziałujących z aktywatorami płytek krwi można również uzyskać, stosując środki, które konkurują z niepolimerowymi aktywatorami płytek krwi lub je hamują. Takie środki obejmują inhibitory trombiny (heparyna i hirudyna, szereg syntetycznych inhibitorów, antagoniści adrenaliny), blokery receptorów alfa (fentolamina, dihydroergotamina), antagoniści ADP (dipirydamol, adenozyna i jej analogi strukturalne, fosfokreatyna), antagoniści serotoniny (metysergid). Tylko kilka z wymienionych środków jest faktycznie stosowanych w profilaktyce i terapii wstrząsu różnego pochodzenia.
Ochronę wewnątrzkomórkowych mechanizmów syntezy receptorów białkowych reagujących z aktywatorami agregacji i adhezji płytek krwi oraz hamowanie procesów syntezy tromboksanu możliwe jest przy zastosowaniu leków z różnych grup:
- induktory i stabilizatory cATP, prostacykliny i prostaglandyny PgE2;
- inhibitory fosfolipazy i fosfodiesterazy.
Intensywny rozwój specjalnych środków przeciwpłytkowych rozpoczął się stosunkowo niedawno i nie przyniósł jeszcze wiarygodnych wyników. Obecnie w praktyce klinicznej, oprócz roztworów dekstranu, takie środki przeciwpłytkowe jak kwas acetylosalicylowy, indometacyna, dipiradamol, sulfinpirazon (persantin), prostacyklina (eikoprostenon) i heparyna są szeroko stosowane w celu zapobiegania tworzeniu się białych skrzepów płytkowych.
Niesteroidowe leki przeciwzapalne
Ustalono, że farmakologiczne działanie niesteroidowych leków przeciwzapalnych - kwasu acetylosalicylowego i indometacyny - wynika z ich wpływu na metabolizm eikozanoidów (tromboksanów i prostaglandyn). Prawie wszystkie leki z tej grupy hamują kompleks enzymatyczny znany jako syntetaza prostaglandyn, wywierając w ten sposób swoje specyficzne i antyagregacyjne działanie.
Kwas acetylosalicylowy wchłania się bardzo szybko po podaniu doustnym. Produkt jego hydrolizy, kwas salicylowy, powoduje zahamowanie cyklooksygenazy płytkowej, co zakłóca konwersję kwasu arachidonowego do prostaglandyny O2 i ostatecznie tromboksanu A2. Kwas acetylosalicylowy hamuje agregację indukowaną przez kolagen, ADP, adrenalinę i serotoninę. Chociaż jego GG0 5 wynosi 15 minut, efekt antyagregacyjny utrzymuje się przez kilka dni, co najwyraźniej można wytłumaczyć nieodwracalnym zahamowaniem reakcji syntezy prostaglandyn i zahamowaniem funkcji agregacji płytek przez cały okres ich życia (6-10 dni). Wraz z zahamowaniem cyklooksygenazy płytkowej, kwas acetylosalicylowy w dużych dawkach hamuje cyklooksygenazę ściany naczyniowej i jednocześnie z zahamowaniem syntezy tromboksanu A2 hamuje syntezę prostacykliny w komórkach śródbłonka. W związku z tym kwas acetylosalicylowy należy przepisywać w małych dawkach (3000–5000 mg/dobę) jako lek przeciwagregacyjny, który przede wszystkim hamuje agregację płytek krwi.
Biorąc pod uwagę, że kwas acetylosalicylowy blokuje płytkową cyklooksygenazę przez kilka dni, a śródbłonkową cyklooksygenazę - nie dłużej niż jeden dzień, racjonalne jest przepisywanie leku nie codziennie, ale co 3-4 dni. Dobór optymalnej dawki kwasu acetylosalicylowego dla pacjenta powinien być przeprowadzany indywidualnie, ponieważ istnieje różna wrażliwość pacjentów na działanie przeciwpłytkowe leku. U pacjentów reaktywnych kwas acetylosalicylowy w dawce 0,5 g hamuje agregację płytek krwi o 40-50%, u pacjentów nadreaktywnych - całkowicie lub o 80-90%, a u pacjentów reaktywnych charakterystyczny jest brak działania przeciwpłytkowego przy przyjmowaniu tej samej dawki leku.
Selektywnymi inhibitorami syntetazy tromboksanu są imidazol i jego analogi, które nie blokują cyklooksygenazy. Dipirydamol, stosowany w praktyce klinicznej w leczeniu przewlekłej niedokrwiennej choroby serca jako rozszerzacz naczyń wieńcowych, podobnie jak imidazol selektywnie hamuje syntetazę tromboksanu, zapobiegając syntezie tromboksanu A2. Uważa się, że lek i jego analogi hamują również fosfodiesterazę płytkową, zwiększając w ten sposób stężenie cAMP w płytkach krwi. Oprócz tego dipirydamol hamuje aktywność deaminazy adenozyny i wychwyt adenozyny przez płytki krwi, blokuje wchłanianie serotoniny przez płytki krwi i ich agregację indukowaną przez adrenalinę i kolagen. Istnieją doniesienia o słabej aktywności przeciwpłytkowej leku i jego zdolności w małych dawkach do zwiększania agregacji płytek krwi. Najbardziej niezawodny efekt przeciwpłytkowy można uzyskać dzięki połączeniu dipirydamolu i kwasu acetylosalicylowego.
Heparyna
Spośród środków przeciwzakrzepowych jednym z najskuteczniejszych regulatorów stanu skupienia krwi jest heparyna, zwłaszcza stosowana wcześnie. Heparyna ma wysoki ładunek ujemny i jest zdolna do interakcji zarówno z dużymi, jak i małymi jonami i cząsteczkami (enzymami, hormonami, aminami biogennymi, białkami osocza itp.), więc spektrum jej działania biologicznego jest dość szerokie. Lek ma działanie antytrombinowe, antytromboplastynowe i antyprotrombinowe, zapobiega przekształcaniu fibrynogenu w fibrynę, hamuje retrakcję skrzepu i zwiększa fibrynolizę.
Mechanizm działania przeciwzakrzepowego heparyny jest dość złożony. Obecnie ustalono, że działanie przeciwzakrzepowe heparyny jest związane z potencjalizacją działania antytrombiny III i zwiększeniem zdolności kompleksu heparyna-antytrombina III do szybkiej inaktywacji większości serynowych proteaz układu krzepnięcia krwi. W działaniu przeciwzakrzepowym heparyny ogromne znaczenie ma jej zdolność do zwiększania i utrzymywania wysokiego potencjału elektroujemnego błony wewnętrznej naczyń, zapobiegając przyleganiu płytek krwi i tworzeniu mikrozakrzepów płytkowych. Heparyna najaktywniej hamuje powstawanie zakrzepów w żyłach, zapobiegając zarówno miejscowemu tworzeniu się zakrzepów, jak i rozsianemu wykrzepianiu wewnątrznaczyniowemu.
Prostacyklina i jej stabilne analogi
Spośród leków przeciwpłytkowych najsilniejszymi inhibitorami agregacji są prostacyklina i jej stabilne analogi. Działanie przeciwpłytkowe prostacykliny wynika ze stymulacji cyklazy adenylowej i w konsekwencji wzrostu stężenia cAMP w płytkach krwi, zmniejszenia zawartości tromboksanu, zmniejszenia zawartości tromboksanu A2 i blokady jego receptorów. Prostacyklina jest niestabilna i szybko hydrolizuje do nieaktywnych produktów, dlatego podaje się ją dożylnie kroplówką w tempie 2 do 20 ng/kg na minutę przez 30-60 minut do 6 razy dziennie.
Prostacyklina, oprócz silnego działania antyagregacyjnego, ma silne działanie rozszerzające naczynia krwionośne i oskrzela. Lek rozszerza naczynia mózgu, serca, nerek, mięśni szkieletowych i naczyń krezkowych. Pod wpływem prostacykliny zwiększa się przepływ krwi wieńcowej, zwiększa się zaopatrzenie mięśnia sercowego w energię i zmniejsza się jego zapotrzebowanie na tlen. Pomimo niestabilności w organizmie, korzystne klinicznie efekty mogą utrzymywać się przez kilka tygodni, a nawet miesięcy. Mechanizm takiego przedłużonego działania nie jest jeszcze jasny.
Prostacyklina jest lekiem o niskiej toksyczności, ale jej stosowanie może powodować skutki uboczne: zaczerwienienie twarzy, bóle głowy, obniżone ciśnienie krwi, bóle brzucha, anoreksję. Oprócz prostacykliny jej syntetyczne stabilne analogi (iloprost itp.) są obiecującymi inhibitorami agregacji płytek krwi.
Leki poprawiające lepkość krwi
Zaburzenia właściwości reologicznych krwi podczas urazu i wstrząsu są spowodowane nie tylko zmianami w czynnościowej aktywności płytek krwi, ale także wzrostem lepkości krwi. Lepkość strukturalna krwi jako złożonego dynamicznego układu rozproszonego jest w dużej mierze determinowana przez lepkość osocza i zdolność erytrocytów do deformacji. Lepkość osocza zależy głównie od stężenia białek we krwi. Białka o małej masie cząsteczkowej, takie jak albumina, mają niewielki wpływ na lepkość osocza, podczas gdy białka o dużej cząsteczce (fibrynogen, alfa- i gamma-globuliny, inne makrocząsteczki) znacznie ją zwiększają.
Przy niskich szybkościach ścinania adsorpcja fibrynogenu i globulin na powierzchni erytrocytów prowadzi do tworzenia mostków między sąsiadującymi komórkami i tworzenia agregatów z erytrocytów. Szybkość tworzenia agregatów jest złożonym procesem biofizycznym i zależy nie tylko od wielkości ścinania, ale także od właściwości elektrokinetycznych erytrocytów, stężenia, masy i pojemności sorpcyjnej makrocząsteczek-agregatorów, od kształtu i plastyczności erytrocytów.
Utrzymanie kształtu i właściwości mechanicznych błony erytrocytu wymaga znacznego wydatku energii. Uważa się, że energia wytwarzana w erytrocytach podczas glikolizy jest zużywana na fosforylację spektryny, co powoduje zmiany w strukturze drugorzędowej białka i interakcję z sąsiednimi składnikami błony wewnętrznej. Interakcja między białkami strukturalnymi błony, spektryną i aktyną, odgrywa ważną rolę w kształtowaniu właściwości mechanicznych błony erytrocytu, w utrzymywaniu stałej powierzchni erytrocytu i jego grubości przy każdej deformacji.
W przypadku zaburzeń hemodynamicznych i narządowych układu krążenia, wzrost sztywności błon erytrocytów i tworzenie agregatów erytrocytów prowadzi do zmniejszenia szybkości przepływu erytrocytów przez naczynia włosowate, zakłócając tym samym funkcję transportu gazów przez krew. Dlatego też korekcja zaburzeń właściwości reologicznych krwi w stanie szoku powinna obejmować, oprócz zapobiegania agregacji erytrocytów, normalizację lepkości osocza i krwi, agregację i deformację erytrocytów.
Oprócz niskocząsteczkowych dekstranów, roztwory albuminy są jednym ze skutecznych środków zwiększających stabilność zawiesiny krwi. W późnym okresie wstrząsu, uogólniona agregacja erytrocytów występuje na tle spadku stężenia albuminy w osoczu krwi i wzrostu stężenia fibrynogenu i globulin, zwłaszcza frakcji alfa2, lipoprotein i lipidów. W tych warunkach reologiczne efekty albuminy wynikają z dwóch głównych czynników: hemodylucji i normalizacji stosunku między białkami mikro- i makroglobularnymi w osoczu. Jednocześnie albumina wiąże wolne kwasy, których labilizacja podczas urazu i wstrząsu stymuluje agregację struktur komórkowych krwi i wewnątrznaczyniowe wykrzepianie i może powodować zator tłuszczowy.
Środki przeciwwstrząsowe mające na celu uzupełnienie objętości krwi krążącej, eliminujące niedotlenienie tkanek i kwasicę metaboliczną, przyczyniają się do normalizacji elastyczności błon erytrocytów, ponieważ niedotlenienie i kwasica znacznie zmniejszają odkształcalność erytrocytów. Zwiększona sztywność błon erytrocytów w szoku jest prawdopodobnie związana z zahamowaniem syntezy ATP w erytrocytach. Z kolei spadek stężenia ATP przyczynia się do wzrostu stężenia Ca2+ w erytrocytach, który wiążąc się z białkami błonowymi, zwiększa sztywność błony.
Jednym z leków farmakologicznych zwiększających zawartość ATP w erytrocytach i elastyczność błon erytrocytów jest Trental (pentoksyfilina), stosowany w praktyce klinicznej w leczeniu chorób niedokrwiennych.
Oprócz zmniejszania sztywności błon erytrocytów, Trental powoduje rozszerzenie naczyń krwionośnych, poprawia natlenienie tkanek, hamuje aktywność fosfodiesterazy w tkankach, zwiększa stężenie cAMP i hamuje agregację płytek krwi.
Spośród innych środków farmakologicznych utrzymujących elastyczność błony erytrocytów warto zwrócić uwagę na antagonistów Ca2+, które ograniczają przepływ jonów do erytrocytów (flunaryzyna, nifedypina i inne).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Uwaga!
Aby uprościć postrzeganie informacji, niniejsza instrukcja użycia narkotyku "Leki zapobiegające zakrzepicy i poprawiające reologię krwi" została przetłumaczona i przedstawiona w specjalnej formie na podstawie oficjalnych instrukcji użycia leku w celach medycznych. Przed użyciem przeczytaj adnotację, która przyszła bezpośrednio do leku.
Opis dostarczony w celach informacyjnych i nie jest wskazówką do samoleczenia. Potrzebę tego leku, cel schematu leczenia, metody i dawkę leku określa wyłącznie lekarz prowadzący. Samoleczenie jest niebezpieczne dla twojego zdrowia.

