Ekspert medyczny artykułu
Nowe publikacje
Leki
Leki zapobiegające zakrzepicy i poprawiające reologię krwi
Ostatnia recenzja: 23.04.2024

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
W zapobieganiu powstawania wielu mikroukładów podczas wstrząsu i ich niszczenia mogą pojawić się różne podejścia farmakologiczne, w których stosuje się leki, które zapobiegają zakrzepicy i poprawiają reologię krwi:
- eliminacja ogólnoustrojowych zaburzeń hemodynamicznych i mikrokrążenia za pomocą środków wazoaktywnych i inotropowych;
- środki poprawiające reologię krwi za pomocą racjonalnej terapii infuzyjnej i leków przywracających elastyczność błon erytrocytów (trental lub pentoksyfilina);
- zapobieganie agregacji płytek i powstawanie początkowych "białych" skrzeplin w małych naczyniach tętniczych z późniejszym uruchomieniem kaskady krzepnięcia;
- hamowanie tworzenia skrzepliny po włączeniu ogólnoustrojowej kaskady krzepnięcia;
- Aktywacja fibrynolizy rozpuścić nowo utworzonej skrzepliny (fibrynolizyny, streptokinaza, Streptodekaza, urokinaza, itd.), Lub, alternatywnie, hamowanie fibrynolizy w ogólności w niektórych pacjentów z urazowym wstrząs i posocznica (kwas aminokapronowy, ambenom, contrycal i in.).
Większość tych podejść jest tradycyjna, dobrze rozwinięta w praktyce leczenia wstrząsu, mają swoje własne wskazania hemoreologiczne i są określone w odpowiednich rozdziałach. Dlatego w tej sekcji warto rozważyć ogólne podejście do zapobiegania powstawaniu skrzeplin w szoku za pomocą środków farmakologicznych, które wpływają na profazę krzepnięcia krwi. To właśnie ten poziom zapobiegania powikłaniom krzepnięcia - występowaniu, powstawaniu i wzrostowi "białkowych zakrzepów krwi tętniczej" - przyciąga największą uwagę badaczy.
Różnorodne często różniące zaburzenia krzepnięcia z pogorszenia jego właściwości reologicznych charakterystycznych dla różnych rodzajów prądem. Najbardziej charakterystyczną septyczny, wstrząs endotoksyczny, oparzenia, urazu i krwotoczny typy wstrząsu jest powstawanie wielokrotnych microthrombi w najmniejszych naczyniach spowodowane zaburzenia hemodynamiczne układowy, zaburzenia skurczu naczyń i mikrokrążenia, zakrzepów, sladzhingom, zmniejszenie elastyczności błon erytrocytów, jak również szereg czynników i miejscowe ( autakoidy), inicjowanie lokalnych zmian krzepnięcia i inkorporacji profaza krzepnięcia.
W schemacie (skróconym) początkowy etap hemocoagulacji i mechanizm miejscowej homeostazy hemocoagulacji przedstawiono w następujący sposób.
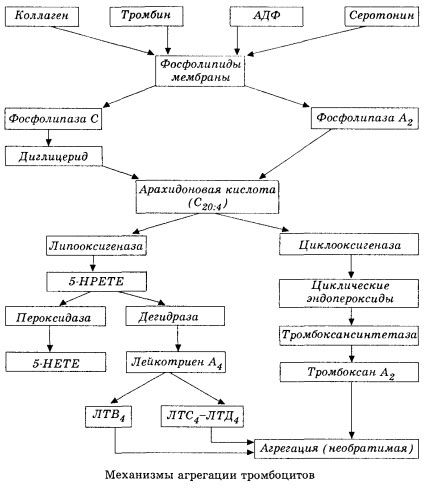
Zaczyna się aktywację fosfolipazy A2 membrany na skutek ekspozycji wynosi czynniki uszkadzające (bezpośrednie uszkodzenie błony, niedotlenienie, peroksydację lipidów, wpływu czynników endogennych i chemikalia m. G). W wyniku rozszczepienia fosfolipidów błony, niezestryfikowane kwasy tłuszczowe o długim łańcuchu są uwalniane, z których najważniejszym jest pierwotny substrat kwas arachidonowy. Jej przekształcenie (kaskady kwasu arachidonowego) znajduje się lipoksygenazę (syntezy leukotrienów) i cyklooksygenazy (synteza prostaglandyny, prostacykliny, tromboksany) trasy.
Figury leukotrieny (B4, C4, E4, D4 i in.), - substancje o bardzo wysokiej aktywności biologicznej, które obejmują reagując substancję anafilaksji dołączyć wielkie znaczenie w inicjacji miejscowego naczyniowe, stany zapalne i reakcje immunologiczne, w tym procesów autoimmunologicznych. Leukotrieny powodować zaburzenia mikrokrążenia, zwiększenie krzepnięcia krwi, autolitycznego uwalniania enzymów lizosomalnych i współczynnik rozdzielania w krwi, naciśnięcie kurczliwości mięśnia sercowego, skurcz oskrzeli.
Ze zdolnością do wywoływania skurczu mięśni gładkich, leukotrienów znaczący wpływ na hemodynamiki układowej, naczyń wieńcowych i mięśnia sercowego, zapewniając mocny koronarokonstriktornoe i negatywny wpływ inotropowy, czemu towarzyszy zmniejszenie pojemności minutowej serca i odgrywa ważną rolę w rozwoju niedociśnienia.
Zmniejszona pojemność minutowa serca i odpowiedź hipotensyjna na działanie leukotrienów jest związana z osłabieniem mięśnia sercowego i ograniczeniem powrotu żylnego do serca. Istotną rolę w ograniczaniu powrotu żylnego ma zdolność leukotrienów do zwiększania przepuszczalności ściany naczynia i wywoływania wynaczynienia osocza. Leukotrieny są ważne w patogenezie zawału mięśnia sercowego.
W anafilaktycznego i septycznego (endotoksyczny) prądem, ich znaczenie wydaje się jeszcze bardziej zwiększona, co świadczy o zdolności leukotrienów gromadzą się w dużych ilościach w osoczu w reakcjach alergicznych i powodują zmiany strumienia krwi układowej, typowe wstrząs anafilaktyczny, jak również działanie ochronne blokerów receptorów leukotrienu i lipoksygenazy. Opracowanie selektywnych blokerów receptorów leukotrienów jest wystarczająco intensywnie i jest obiecująca dziedzina nauki. W tej dziedzinie osiągnęliśmy pewien sukces i doświadczalnie potwierdzono skuteczność takich blokerów w niedokrwieniu mięśnia sercowego, wstrząs krwotoczny i endotoksyny. Jednakże przed klinicznym realizacji tego kierunku odbędzie się prawdopodobnie kilka lat.
Jeśli naczyń żylnych skrzeplin są wykonane w równej udziałem płytek i czynników krzepnięcia krwi w osoczu, a w tętnicach płytki głównie inicjowany proces. Zawierają one ADP, Ca2 +, serotoninę, fosfolipidy, enzymów syntetyzujących prostaglandyny i tromboksany trombostenin (podobnie actomyosin skurczu mięśni zapewnia zdolność tych komórek) i nabłonkowy czynnik wzrostu zakrzepowe i komórkach mięśni ścian naczyń i innych substancji. Humoralną regulacja czynności płytek krwi prowadzi się poprzez wyspecjalizowane receptory błon (receptory alfa2- i beta2-adrenergiczne, receptory histaminowe i serotoniny, acetylocholiny, tromboksanu adenozyna, i inne). Szczególną właściwością płytek - wysokie powinowactwo do kolagenu i innych elementów podśródbłonkowej ściany naczynia, by w pozbawionych i niezwilżalne powierzchnie ujemny. Ta cecha umożliwia płytek wyjątkową przyczepność (adhezję) do części śródbłonka naczyń jest uszkodzone, co występuje, gdy uszkodzenie możliwości wstrząsy. Gdy to spłaszczenie płytki i uwolnienia nibynóżki, który może się łączyć ze sobą oraz ze ścianką naczynia. Zwiększa przepuszczalność błon płytek krwi i są uwalniane ADP, serotoniny tromboksanu i pewnych czynników krzepnięcia zaadsorbowanych na powierzchni płytek. Substancje te oddziałują z odpowiednimi receptorami na membranie i przy udziale jonów wapnia powodują agregację (początkowo odwracalną). Proces ten staje się samowystarczalny, ułatwiony przez czynniki regulacyjne czynników humoralnych; inne czynniki, wręcz przeciwnie, mogą go zatrzymać, a nawet odwrócić, powodując dezagregację.
Z występowaniem efektów skrzeplin i warunki adhezji i agregacji fazy zastąpiony trzecim etapie odwracalnego - łączenie nieodwracalny, co jest realizowane za pomocą trombostenina prowadzi do zwężenia skrzepu; reakcja utwardzania agregatu i zwężenie występuje również przy udziale Ca +, ATP i prowadzi do powstania białego zakrzepu.
Cyklooksygenaza szlaku przemian kwasu arachidonowego w płytkach krwi, komórek śródbłonka naczyń i w innych tkankach, miejscowego (czas półtrwania jest bardzo mała metabolitów) krzepnięcia homeostazie, jak silne pro substancje przeciwpłytkowe są tworzone w tym metabolizmu. Głównym czynnikiem, który aktywuje agregacji płytek krwi w reakcji łańcuchowej Cyklooksygenaza tromboksanu A2 i jej nie mniej silnym antagonistą - prostacykliny wytwarzany przez komórki śródbłonkowe, i, w mniejszym stopniu, prostaglandyny serii E i G. Ponadto, agregacja płytek jest silnie uzależnione od innych lokalnych i ogólnoustrojowe czynniki humoralne.
Aktywatory i inhibitory agregacji płytek krwi
|
Inicjatory i aktywatory agregacji płytek |
Inhibitory agregacji płytek |
|
Kolagen |
- |
|
ADP |
Adenozyna i jej stabilizatory |
|
Noradrenalina (poprzez receptory alfa2) |
Środki alfa-adrenergiczne |
|
Serotonina |
Środki antyserotoninowe |
|
Histamina |
Leki przeciwhistaminowe |
|
Trombina |
Heparyna |
|
Sa2 + |
Antagoniści Ca2 + |
|
CGMP - jego induktory (acetylocholina?) i stabilizatory |
CAMP - jego induktory (poprzez receptory beta-adrenergiczne) i stabilizatory (inhibitory fosfodiesterazy) |
|
Kwas arachidonowy |
Dekstrany, albumina |
|
Tromboksan A2 |
Prostacyklina I2 |
Interwencje farmakologiczne w początkowej fazie zakrzepicy w szoku i ostrych procesów niedokrwiennych w sercu i mózgu sugerują następującą możliwość:
- hamowanie początkowych reakcji (ogólnych i częściowych) kaskady kwasu arachidonowego;
- hamowanie częściowej reakcji syntezy tromboksanów;
- blokowanie receptorów dla leukotrienów i tromboksanów w płytkach krwi, mięśniach gładkich i innych komórkach;
- stosowanie substancji modulujących agregację płytek krwi, tj. Osłabianie w inny sposób reakcji tych ostatnich na działanie czynników inicjujących (kolagen, tromboksan A2, leukotrieny itp.).
Realizacja tych ścieżek korekcji reologię krwi stanowi główne zadania decyzyjne taktyczne: ochrona receptora agregacji i adhezji płytek krwi przez ekspozycję aktywatorów lub hamować wewnątrzkomórkowe mechanizmy syntezy tych receptorów. Hamowanie początkowych reakcjach kaskadzie kwasu arachidonowego, można osiągnąć przez zabezpieczenie receptora płytek elastycznych aktywatorów polimerowej, za pomocą dekstranów o niskiej masie cząsteczkowej, które konkurują z cząsteczkami fibryna, kolagen, zagregowane immunoglobuliny (IgE) i składników układu dopełniacza.
Poprzez maskowanie receptorów na membranie płytek krwi i konkurowanie z dużymi rozproszonymi białkami na powierzchni krwinek czerwonych, dekstranty o niskiej masie cząsteczkowej wypierają je i niszczą mostki między komórkami. Wynika to z faktu, że dekstrany, otaczające śródbłonek naczyniowy i powierzchnię komórkowych elementów krwi, zwiększają ich ładunek ujemny, zwiększając w ten sposób właściwości przeciwagregacyjne.
dekstrany
Dekstrany o niskiej masie cząsteczkowej, redukując kolagenu indukowanej przez ADP agregacji płytek krwi, jak również aktywacji działanie trombiny w płytkach krwi, hamuje wzrost początkowej skrzepliny białego płytkowego, poprawę przepływu krwi, zmniejszenie wzrostu w okresie pooperacyjnym zawartości fibrynogenu w osoczu zmieniają strukturę i stabilność fibryny.
Dożylne infuzje dekstranów z uszkodzeniem i wstrząsem nie tylko do zmniejszenia adhezji i agregacji płytek krwi, lecz również mobilizacji endogenną heparyną, co sprzyja tworzeniu się luźne i słabo retragiruemogo zakrzepu krwi, który łatwo lizie fibrynolityczne. Aktywność antytrombiny dekstransów o niskiej masie cząsteczkowej jest związana z ich specyficznym wpływem na strukturę i funkcję czynnika VIII krzepnięcia krwi. Czynnik VIII (globulina antyhemofilowa), wielkocząsteczkowa o złożonej strukturze i funkcji, bierze udział w agregacji płytek krwi i stabilności utworzonego skrzepu. Dekstrany zakłócają działanie czynnika VIII, spowalniając w ten sposób agregację płytek i zmniejszając stabilność skrzepu.
Dekstrany o małej masie cząsteczkowej, nie są prawdziwymi przeciwzakrzepowe i ich działanie na zaburzenia hemorheological naprawcze związane głównie hemodylucji, zakończenie krążącej objętości osocza i zwiększony przepływ krwi w układzie mikrokrążenia.
Zdolność dekstranów do poprawy przepływu krwi w zaburzeniach hemodynamicznych (wstrząs, utrata krwi) jest spowodowana złożonym czynnikiem. Pojawienie się we krwi wysokiej przejściowej koncentracji polimeru nie tylko prowadzi do "bezpośredniej hemodylucji", ale także tworzy warunki dla przepływu płynu do krwioobiegu z przestrzeni śródmiąższowej, a następnie równoważenia osmotycznego efektu dekstranu. W wyniku hemodylucji zmniejsza się lepkość krwi, zwiększa się przepływ żylny do serca i maleje objętość serca. Wraz z tymi efektami dekstrany tworzą kompleksy z fibrynogenem i mają działanie antylipemiczne.
Tak więc efekt przeciwagregacyjny i efekty hemodynamiczne dekstranu o niskiej masie cząsteczkowej przyczyniają się do zmniejszenia lepkości krwi, co jest szczególnie ważne przy niskich szybkościach ścinania. Dezagregacja elementów krwi poprawia systemowy przepływ krwi i mikrokrążenie, zwłaszcza w jego części żylnej, gdzie gradienty prędkości są najniższe. Zastosowanie niskiej roztworów masy cząsteczkowej dekstranu w różnego rodzaju uderzenia, podczas chirurgicznego leczenia urazów i ich następstw, to pooperacyjne zapobiega nadkrzepliwości i zmniejszają prawdopodobieństwo wystąpienia procesu i zatorów zakrzepowych.
Należy jednak zauważyć, że w niektórych przypadkach do wlewów roztworów dekstranu towarzyszą reakcje anafilaktyczne i alergiczne (niebezpieczne w przypadku uczulenia i wstrząsu anafilaktycznego). Wynika to z faktu, że dekstrany o dużej masie cząsteczkowej i wiele łańcuchów bocznych może działać jako antygen. W związku z tym, w celu ustalenia indywidualnej wrażliwości zaleca się podawać dożylnie w haptenu do 20 ml roztworu o niskiej masie cząsteczkowej dekstranu (15% roztwór, o masie cząsteczkowej 1000) i przeprowadzić infuzję zastępczej osocza przed podaniem narkozy.
 [9], [10], [11], [12], [13], [14], [15], [16], [17], [18]
[9], [10], [11], [12], [13], [14], [15], [16], [17], [18]
Inhibitory trombiny
Farmakologiczne receptory ochrony współdziałające z płytek aktywatory płytek mogą być również uzyskiwane za pomocą konkurować z niepolimerowych aktywatorów płytek lub hamujące. Takie środki obejmują inhibitory trombiny (heparyny i hirudyny, szereg syntetycznych inhibitorów antagonistów adrenaliny), blokery receptorów alfa (fentolamina, dihydroergotamina) antagoniści ADP (dipirydamol adenozyna i jego analogi strukturalne fosfokreatyna), antagoniści serotoniny (metizergid). Tylko kilka z tych leków jest faktycznie używanych do zapobiegania i leczenia szoku o różnej genezie.
Ochrona mechanizmów wewnątrzkomórkowych do syntezy receptorów białkowych reagujących z agregacją i promotorami adhezji płytek oraz hamowanie procesów syntezy tromboksanu jest możliwa dzięki preparatom różnych grup:
- induktory i stabilizatory cATP, prostacykliny i prostaglandyny PgE2;
- inhibitory fosfolipazy i fosfodiesterazy.
Intensywny rozwój konkretnych leków przeciwpłytkowych rozpoczął stosunkowo niedawno i nie doprowadziła jeszcze do wiarygodnych wyników. Obecnie w praktyce klinicznej, aby zapobiec powstawaniu skrzepów płytek białego wyjątkiem dekstranów rozwiązaniach powszechnie stosowane środki przeciwpłytkowe, takie jak kwas acetylosalicylowy, indometacyna, dipiradamol, sulfinpirazon (persantyna), prostacyklina (eykoprostenon) heparyny.
Niesteroidowe leki przeciwzapalne
Okazuje się, że farmakologiczne działanie niesterydowych leków przeciwzapalnych - kwas acetylosalicylowy, indometacyna, a ze względu na ich wpływ na metabolizm eikozanoidów (prostaglandyn i tromboksanów). Niemal wszystkie leki z tej grupy hamują kompleks enzymów, znany jako syntetaza prostaglandyn, zapewniając w ten sposób swoiste działanie przeciwpłytkowe.
Kwas acetylosalicylowy po spożyciu wchłania się bardzo szybko. Jego produkt hydrolizy, kwas salicylowy, powoduje hamowanie cyklooksygenazy płytek krwi, w wyniku czego dochodzi do przerwania konwersji kwasu arachidonowego do prostaglandyny 02 i ostatecznie do tromboksanu A2. Kwas acetylosalicylowy hamuje agregację indukowaną przez kolagen, ADP, epinefrynę i serotoninę. Chociaż U0 5 to 15 minut, efekt przeciwpłytkowy trwa kilka dni z powodu, widocznie nieodwracalnego hamowania reakcji syntezy prostaglandyny i hamując agregację płytek krwi w funkcji przez cały okres ich życia (6 do 10 dni). Wraz z hamowaniem płytek cyklooksygenazy, kwas acetylosalicylowy w dużych dawkach hamuje cyklooksygenazę ściany naczyniowej i równocześnie z supresji syntezy tromboksanu A2 i prostacykliny hamuje syntezę w komórkach śródbłonka. Dlatego też mianowanie kwasu acetylosalicylowego jako antyagregatu powinno odbywać się w małych dawkach (3000-5000 mg / dzień), które preferencyjnie hamują agregację płytek.
Biorąc pod uwagę, że bloki aspiryna cyklooksygenazy płytek krwi w ciągu kilku dni, podczas gdy śródbłonka cyklooksygenazy - nie więcej niż jeden dzień, to jest racjonalne, aby przepisać lek codziennie, a po 3-4 dniach. Wybór dla pacjenta optymalną dawkę kwasu acetylosalicylowego należy przeprowadzić indywidualnie, ponieważ występuje inna wrażliwość pacjentów na działanie przeciwpłytkowe leku. U pacjentów ze strumieniem kwasu acetylosalicylowego w dawce 0,5 g hamuje agregację płytek krwi o 40-50%, na hyperreactive - całkowicie lub 80-90%, a dla pacjentów charakteryzujących się brak brak reakcji działania przeciwpłytkowego, gdy do tej samej dawki.
Selektywnymi inhibitorami syntetazy tromboksanu są imidazol i jego analogi, które nie blokują cyklooksygenazy. Dipirydamol stosowane w praktyce klinicznej w leczeniu przewlekłej choroby niedokrwiennej serca, jako koronarodilyatator jak imidazol selektywnie hamuje syntetazy tromboksanu hamowanie syntezy tromboksanu A2. Uważa się, że lek i jego analogi hamują fosfodiesterazę płytek krwi, zwiększając w ten sposób stężenie cAMP w płytkach krwi. Wraz z tym dipirydamol hamuje aktywność deaminazy adenozyny i adenozyny płytki przechwytywania, blokuje wychwyt serotoniny i agregację płytek indukowaną przez kolagen i adrenaliny. Istnieją doniesienia o słabej aktywności przeciwpłytkowej leku i jego zdolności do zwiększania agregacji płytek w małych dawkach. Najbardziej wiarygodny efekt przeciwpłytkowy można uzyskać dzięki połączeniu dipirydamolu z kwasem acetylosalicylowym.
Heparyna
Wśród środków przeciwzakrzepowych jednym z najskuteczniejszych regulatorów stanu skupienia krwi jest heparyna, zwłaszcza we wczesnym jej stosowaniu. Heparyna ma wysoki ładunek ujemny i jest w stanie oddziaływać zarówno z dużymi jak i małymi jonami i cząsteczkami (enzymami, hormonami, aminami biogennymi, białkami osocza itp.), Więc spektrum jego biologicznego działania jest dość szerokie. Lek ma działanie antytrombiny, antytromboplastyny i antyprotrombinovoe, zapobiega przejściu fibrynogenu w fibrynę, hamuje retrakcję skrzepu, zwiększa fibrynolizę.
Mechanizm działania przeciwzakrzepowego heparyny jest dość skomplikowany. Obecnie wiadomo, że przeciwzakrzepowe heparyny związane z wzmagania antytrombiny III oraz wzmocnienie zdolności kompleks heparyna-antytrombiny III szybko inaktywacji większość proteazy serynowej krzepnięcia krwi. Działanie przeciwzakrzepowe heparyny znaczenie ma zdolność do zwiększania i utrzymywania wysokiego elektroujemny potencjału błony naczyniowej, która zapobiega adhezji płytek krwi i w tworzeniu się płytek microthrombi. Najbardziej aktywna heparyna hamuje powstawanie zakrzepów w żyłach, zapobiegając w ten sposób powstawaniu skrzepów i rozsianej wewnątrznaczyniowej koagulacji.
Prostacyklina i jej stabilne analogi
Wśród leków przeciwpłytkowych najsilniejszymi inhibitorami agregacji są prostacyklina i jej stabilne analogi. Działanie przeciwpłytkowe ze względu na stymulację cyklazy adenylanowej prostacykliny i w konsekwencji - wzrost stężenia cAMP w płytkach krwi, zmniejszenie zawartości tromboksanu, zmniejszoną zawartość tromboksanu A2 i blokadę receptora. Prostacykliny jest nietrwały i szybko hydrolizuje do produktów nieaktywnych, więc wprowadza się do kroplówki żyły z szybkością od 2 do 20 ng / kg na minutę przez 30-60 minut do 6 razy dziennie.
Prostacyklina, wraz z silnym działaniem antyagregacyjnym, ma silne działanie zwężające naczynia krwionośne i działanie rozszerzające oskrzela. Lek rozszerza naczynia mózgu, serca, nerek, mięśni szkieletowych i naczyń krezkowych. Pod wpływem prostacykliny wzrasta przepływ wieńcowy, zwiększa się dostarczanie energii do mięśnia sercowego i zmniejsza się zapotrzebowanie na tlen. Pomimo niestabilności w ciele, klinicznie korzystny efekt może trwać kilka tygodni, a nawet miesięcy. Mechanizm takiego przedłużonego działania nie jest jeszcze jasny.
Prostacyklina jest lekiem o niskiej toksyczności, jednak może powodować działania niepożądane: przekrwienie twarzy, bóle głowy, obniżenie ciśnienia krwi, bóle brzucha, anoreksję. Wraz z prostacykliną obiecującymi inhibitorami agregacji płytek są jej syntetyczne stabilne analogi (iloprost itp.).
Leki, które poprawiają lepkość krwi
Naruszenie reologicznych właściwości krwi podczas urazu i wstrząsu wynika nie tylko ze zmiany czynnościowej czynności płytek krwi, ale także ze wzrostu lepkości krwi. Lepkość strukturalna krwi jako złożonego dynamicznego układu dyspersyjnego jest w dużym stopniu określona przez lepkość plazmy i zdolność erytrocytów do deformacji. Lepkość osocza zależy głównie od stężenia białek we krwi. Białka o niskiej masie cząsteczkowej, typu albumina mają niewielki wpływ na lepkość w osoczu, podczas gdy w przypadku dużych cząsteczek białka (fibrynogen, alfa i gamma globuliny inne makrocząsteczki), jest znacznie zwiększona.
Przy niskich prędkościach ścinania fibrynogenu adsorpcji na powierzchni erytrocytów i wyniki globuliny w tworzeniu mostków pomiędzy sąsiadującymi komórkami i agreganty powstawania erytrocytów. Szybkość tworzenia się agregatów jest złożonym procesem i Biophysical zależy nie tylko od wielkości przesunięcia, ale także elektrokinetycznego właściwości erytrocytów, stężenia, masy ciała i sorpcyjnych makrocząsteczek zdolności agreganty kształt i ciągliwości erytrocytów.
Zachowanie kształtu i właściwości mechanicznych błony erytrocytów wymaga znacznej ilości energii. Uważa się, że energia wytworzona w erytrocytach podczas procesu glikolizy jest zużywana na fosforylację spektryny, w wyniku czego struktura drugorzędowa białka zmienia się i oddziałuje z sąsiednimi składnikami błony wewnętrznej. Interakcja między białkami strukturalnymi błon, widmą i aktyną odgrywa ważną rolę w tworzeniu właściwości mechanicznych błony erytrocytów, w utrzymywaniu stałego pola powierzchni erytrocytów i jego grubości dla dowolnego odkształcenia.
Podczas łamania układowy hemodynamiki i przepływ krwi błon erytrocytów narządów usztywniających i tworzenie erytrocytów agreganty zmniejsza prędkość przechodzenia erytrocytów przez kapilary, łamiąc w ten sposób funkcję gazu transportowego krwi. Dlatego korekcja zaburzeń reologicznych we krwi podczas wstrząsu powinna zapewnić, wraz z zapobieganiem agregacji erytrocytów, normalizację lepkości osocza i krwi, agregację i deformację erytrocytów.
Oprócz dekstranów o niskiej masie cząsteczkowej, roztwory albuminy są jednym ze skutecznych środków zwiększania stabilności zawiesiny krwi. Pod koniec okresu wstrząsu, uogólnione agregacji czerwonych krwinek występuje ze względu na obniżenie stężenia albuminy w osoczu krwi, a wzrastające stężenia fibrynogen i globuliny, w szczególności alfa-2 frakcje, lipoprotein i lipidów. W tych warunkach reologiczne działanie albumin są spowodowane dwoma głównymi czynnikami: hemodilucją i normalizacją związków między białkami osocza mikro- i makroglobularnego. Równocześnie albumina wiąże wolne kwasy, których wargowanie w urazie i szoku stymuluje agregację komórkowych struktur krwi i wewnątrznaczyniową koagulację i może powodować zator tłuszczowy.
środki anty-shock zmierzające do uzupełnienia objętości krwi krążącej, usunięcie niedotlenienie tkanek, kwasicy metabolicznej, promowanie normalizację elastyczności błon erytrocytów od niedotlenienie i kwasica znaczne zmniejszenie odkształcalności krwinek czerwonych. Wzrost sztywności błon erytrocytów w szoku prawdopodobnie wynika z zahamowania syntezy ATP w erytrocytach. Z kolei zmniejszenie stężenia ATP promuje stężenia Ca2 + w erytrocytach, które wiążąc się z błoną białek zwiększa sztywność membrany.
Jednym z czynników farmakologicznych, które zwiększają zawartość ATP erytrocytów i elastyczności błon erytrocytów wynosi Trental (pentoksyfilina) stosowane w praktyce klinicznej w leczeniu zaburzeń niedokrwiennych.
Wraz ze zmniejszeniem sztywności błon erytrocytów Trentalum powoduje rozszerzenie naczyń krwionośnych, zwiększa natlenienie tkanki w tkance, która hamuje aktywność fosfodiesterazy, zwiększa stężenie cAMP, hamuje agregację płytek krwi.
Wśród innych środków farmaceutycznych, przy zachowaniu elastyczności błony erytrocytów, należy zauważyć, antagonistami Ca2 + ograniczające przepływ jonów w erytrocytach (flunaryzynę, nifedepin i in.).
Uwaga!
Aby uprościć postrzeganie informacji, niniejsza instrukcja użycia narkotyku "Leki zapobiegające zakrzepicy i poprawiające reologię krwi" została przetłumaczona i przedstawiona w specjalnej formie na podstawie oficjalnych instrukcji użycia leku w celach medycznych. Przed użyciem przeczytaj adnotację, która przyszła bezpośrednio do leku.
Opis dostarczony w celach informacyjnych i nie jest wskazówką do samoleczenia. Potrzebę tego leku, cel schematu leczenia, metody i dawkę leku określa wyłącznie lekarz prowadzący. Samoleczenie jest niebezpieczne dla twojego zdrowia.

