Ludzki wirus upośledzenia odporności (HIV)
Ostatnia recenzja: 23.04.2024

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Zespół nabytego niedoboru odporności został wyizolowany jako szczególna choroba w 1981 r. W Stanach Zjednoczonych, kiedy u wielu młodych ludzi ciężkie choroby były spowodowane przez mikroorganizmy, które nie są patogenne lub lekko patogenne dla zdrowych ludzi. Badanie stanu odpornościowego pacjentów ujawniło gwałtowny spadek liczby limfocytów ogólnie, w szczególności T-pomocników. Ten stan nazywa się AIDS (zespół nabytego niedoboru odporności w języku angielskim - zespół nabytego niedoboru odporności lub AIDS). Sposób zakażenia (kontakt seksualny, krew i jego preparaty) wskazywał na zakaźną naturę choroby.
Czynnik sprawczy AIDS został odkryty w 1983 roku niezależnie przez Francuza L. Montagniera, który nazwał go LAV Lymphoadenopathy Associated Virus), gdy wykrył pacjenta z limfadenopatią; oraz amerykański R. Gallo, który nazwał wirusa HTLV-III (angielski ludzki T-limfotropowy wirus III): wcześniej stwierdzono wirusy limfotropowe I i II.
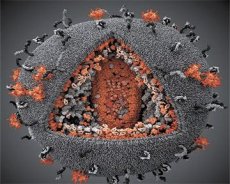
Porównanie właściwości wirusów LAV i HTLV-III ujawniło ich tożsamość, dlatego w 1986 r. Wirus nosił nazwę HIV (ludzki wirus upośledzenia odporności lub HIV), aby uniknąć nieporozumień. HIV jest kulisty, jego średnica wynosi 110 nm. Obwiednia wirusa ma postać wielościanu złożonego z 12 pięciokątów i 20 sześciokątów. Cząsteczka glikozylowanego białka gpl20 znajduje się w środku i na rogach każdego sześciokąta (liczba 120 oznacza masę cząsteczkową białka w kilodaltonach). Ogółem cząsteczki 72 gpl20 znajdują się na powierzchni wirionu, z których każdy jest związany z białkiem wewnątrzbłonowym gp41. Te białka razem z podwójną warstwą lipidową tworzą superkapsyd (membranę) wirionu.
Białka gpl20 i gp41 powstają w wyniku cięcia proteazy komórkowej białka prekursorowego Env. Białko gp41 tworzy "kolczyk" kręgosłupa, połączony przez domenę cytoplazmatyczną z białkiem macierzy p17MA bezpośrednio poniżej błony. Cząsteczki p17, oddziałujące z dojrzewaniem wirionu, tworzą dwudziestościan leżący pod skorupą.
W centralnej części wirionu białko p24 tworzy stożkowaty kapsyd. Zwężona część kapsydu z udziałem białka pb jest połączona z otoczką wirionu. W kapsydzie znajdują się dwie identyczne cząsteczki wirusowego genomowego RNA. Są one związane na ich końcach 5 'z białkiem nukleokapsydowym p7NC. Białko to jest interesujące, że posiada dwie reszty aminokwasowe (motif) zawierający Zn bogaty w cysteinę i histydyna i atom, - są nazywane „palec cynkowy”, ponieważ wychwytywania cząsteczki genomowego RNA, w celu włączenia do wirionów formowanych. Kapsyd zawiera również trzy enzymy. Rewersja (RT) lub kompleks polowy obejmuje odwrotną transkryptazę, RNA-azę H i zależną od DNA polimerazę DNA. Revertaza występuje jako heterodimer p66 / p51. Proteaza (PR) - pI, rozpoczyna i realizuje proces dojrzewania wirionów. Integracja (IN) - p31 lub endonukleaza zapewnia włączenie prowirusowego DNA do genomu komórki gospodarza. Kapsyd zawiera również cząsteczkę RNA zarodkowego (tRNA1 "3).
Gen RNA w komórce jest przekształcany przez odwrotną transkryptazę do genomu DNA (DNA-provirus) składającego się z 9283 par nukleotydów. Jest ograniczona do lewej i prawej strony przez tak zwane długie powtórzenia lub LTR (angielskie długie powtórzenia końcowe): S'-LTR - lewe i Z'-LTR - po prawej. LTR zawiera 638 par nukleotydów.
Genom HIV składa się z 9 genów, z których niektóre pokrywają się (ma kilka ramek odczytu) i mają strukturę egzoninową. Kontrolują syntezę 9 strukturalnych i 6 białek regulatorowych.
Wartość LTR dla genomu wirusowego polega na tym, że zawierają one następujące elementy regulacyjne, które kontrolują jego działanie:
- sygnał transkrypcyjny (region promotora);
- sygnał do dodawania poli-A;
- Sygnał przechwytywania;
- integracja sygnału;
- pozytywny sygnał regulatorowy (TAR dla białka TAT);
- element regulacji negatywnej (NRE dla białka NEF);
- miejsce przyłączenia wyjściowego RNA (tRNA ™ 3) do syntezy ujemnego łańcucha DNA na końcu 3 '; sygnał na końcu 5 'LTR, który służy jako starter do syntezy dodatniej nici DNA.
Ponadto LTR zawiera elementy zaangażowane w regulację splicingu mRNA, pakując cząsteczki vRNA do kapsydu (element Psi). Wreszcie, podczas transkrypcji genomu w długich mRNA, generowane są dwa sygnały dla białka REV, które przełączają syntezę białek: CAR dla białek regulatorowych i CRS dla białek strukturalnych. Jeśli białko REV wiąże się z CAR, syntetyzowane są białka strukturalne; jeśli jest nieobecny, syntetyzowane są tylko białka regulatorowe.
W regulacji genomu wirusa szczególnie ważne są następujące geny regulujące i ich białka:
- białko TAT, które przeprowadza pozytywną kontrolę reprodukcji wirusa i działa poprzez regulacyjne miejsce TAR;
- białka NEV i VPU, prowadzące negatywną kontrolę reprodukcji przez miejsce NRE;
- białko REV, przeprowadzając kontrolę pozytywno-ujemną. Białko REV kontroluje pracę genów gag, pol, env i wykonuje negatywną regulację splicingu.
Tak więc reprodukcja wirusa HIV odbywa się pod potrójną kontrolą - pozytywną, negatywną i pozytywną-negatywną.
Białko VIF określa infekcyjność nowo zsyntetyzowanego wirusa. Jest on związany z białkiem kapsydu p24 i jest obecny w wirionie w ilości 60 cząsteczek. Białko NEF jest reprezentowane w wirionie przez niewielką liczbę cząsteczek (5-10), ewentualnie połączonych z otoczką.
Białko VPR hamuje cykl komórkowy w fazie G2, zaangażowanych w kompleksach preintegratsionnyh transportowej w jądrze komórkowym i uruchamia pewne geny wirusowe i komórkowe, zwiększa efektywność replikacji wirusa w monocytach i makrofagach. Nie ustalono położenia białek VPR, TAT, REV, VPU w wirionie.
Oprócz własnych białek, kompozycja błony wirionowej może zawierać pewne białka komórki gospodarza. Proteiny VPU i VPR biorą udział w regulacji reprodukcji wirusa.
Warianty antygenowe ludzkiego wirusa upośledzenia odporności (HIV)
Ludzki wirus upośledzenia odporności (HIV) jest bardzo zmienny. Nawet z organizmu jednego pacjenta można wyizolować szczepy wirusa różniące się istotnie właściwościami antygenowymi. Taką zmienność sprzyja intensywne niszczenie komórek CD4 + i silna odpowiedź przeciwciał na zakażenie HIV. Pacjenci z Afryki Zachodniej mają nową postać HIV, biologicznie zbliżoną do HIV-1, ale immunologicznie różną od niej, HIV-2. Homologia pierwotnej struktury genomów tych wirusów wynosi 42%. DNA-provirus HIV-2 zawiera 9671 bp, a jego LTR - 854 bp. HIV-2 został następnie wyizolowany w innych regionach świata. Nie ma odporności krzyżowej między HIV-1 a HIV-2. Znane są dwie duże formy HIV-1: O (odstający) i M (główny), te ostatnie są podzielone na 10 podtypów (AJ). W Rosji krąży 8 podtypów (AH).
Mechanizm interakcji HIV z komórką
Po przeniknięciu do organizmu wirus najpierw atakuje komórki zawierające specyficzny receptor CD4. Ten receptor ma dużą liczbę pomocników T, w mniej - makrofagów i monocytów, zwłaszcza wrażliwych na wirusy T-pomocników.
Ludzki wirus upośledzenia odporności (HIV) rozpoznaje receptory CD4 z jego białkiem gpl20. Proces interakcji wirusa HIV z komórką przebiega zgodnie z następującym schematem: adsorpcja za pośrednictwem receptora -> brzegowa fupa -> graniczny pęcherzyk -> lizosom. W nim membrana wirionowa łączy się z błoną lizosomu, a nukleokapsyd uwolniony z superkapsydu wchodzi do cytoplazmy; w drodze do jądra jest niszczona, a genomowe RNA i związane z nim kluczowe składniki są uwalniane. Następnie odwrotną transkryptazę syntetyzuje się na wiriony nici minus RNA DNA, a następnie RNazy H niszczy RNA wirionów i wirusowej polimerazy DNA syntetyzuje DNA Plus łańcuch. Na końcach DNA-prowirusa powstają 5'-LTR i 3'-LTR. Prowirus DNA może znajdować się w jądrze przez pewien czas w formie nieaktywnej, ale prędzej czy później integruje się z pomocą integrazy do chromosomu komórki docelowej. W nim prowirus jest w stanie nieaktywnym do czasu aktywacji limfocytu T przez antygeny drobnoustrojowe lub inne immunokompetentne komórki. Aktywacja transkrypcji komórkowego DNA jest regulowana przez specjalny czynnik jądrowy (NF-kB). Jest to białko wiążące DNA i jest wytwarzane w dużych ilościach podczas aktywacji i proliferacji limfocytów T i monocytów. To białko wiąże się ze specyficznymi sekwencjami komórkowego DNA i podobnymi sekwencjami DNA DNA prowokującego LTR i indukuje transkrypcję zarówno komórkowego DNA, jak i prowirusa DNA. Indukując transkrypcję prowirusa DNA, przechodzi on z nieaktywnego stanu w aktywną, a zatem trwałą infekcję, w produktywny. Pobyt prowirusa w stanie nieaktywnym może trwać bardzo długo. Aktywacja wirusa jest krytycznym momentem w jego interakcji z komórką.
Od momentu wejścia wirusa w komórkę rozpoczyna się okres zakażenia wirusem HIV, który może trwać 10 lat lub dłużej; a ponieważ aktywacja wirusa rozpoczyna się od choroby - AIDS. Dzięki genom regulatorowym i ich produktom wirus zaczyna się aktywnie namnażać. Białko TAT może zwiększyć wskaźnik reprodukcji wirusa 1000 razy. Transkrypcja wirusa jest złożona. Obejmuje tworzenie pełnej długości i subgenomowych mRNA, splicing mRNA i dalszą syntezę białek strukturalnych i regulatorowych.
Synteza białek strukturalnych przebiega następująco. Początkowo syntetyzowane polibiałko prekursor Pr55Gag (białko o m. M. 55 kD). Zawiera on cztery główne domeny: matrycę (MA) kapsydu (CA), nukleokapsydu (NC) i PE domen, których wyniki koszenia Pr55Gag Proteaza wirusowa (IT samovyrezaetsya z innego prekursora białka - Gag-Pol) są utworzone, odpowiednio, białka strukturalne p17 , p24, p7 i pb. Wytwarzanie poliproteiny Pr55Gag jest głównym warunkiem tworzenia cząstek wirusowych. To właśnie to białko określa program morfogenezy wirionu. Obejmuje ona etapy sekwencyjnego poliprotein GAG transport do błony plazmatycznej i jego interakcji z oddziaływań białko-białko w tworzeniu cząstki wirusa i jego pączkowania. Pr55Gag jest syntetyzowany na wolnych polibosomach; cząsteczki białka są transportowane z membraną, która jest zakotwiczona w swoich regionów hydrofobowych. Główną rolę w tworzeniu natywnej konformacji białka odgrywa domenę Gag-CA. Przełącznik NC dziedzinie zawiera (za pomocą „palców cynkowych”) 2 cząsteczki genomowego RNA w wirusowej cząstce tworzącej. Cząsteczka poliproteiny jest najpierw dimeryzowana ze względu na interakcję domen macierzy. Następnie dimery połączone w heksamerycznych (6 jednostek) kompleksów przez interakcję domeny CA i NC. Wreszcie, heksamery, łączące powierzchnie boczne stanowią niedojrzałe wirionów kulisty kształt, w środku, które zawierają wirusowy genomowy RNA przechwycony NC domeny.
Innym białkiem prekursora Prl60Gag-Pol (białko o m. M. 160 kDa) otrzymuje się w wyniku przesunięcia ramki odczytu rybosomu podczas translacji Z'-końcem genu gag w obszarze bezpośrednio przed kodujący białko regionu RB. Ta poliproteina Gag-Pol zawiera niekompletną sekwencję białka Gag (1 - 423 aminokwasów) i sekwencje Pol, które zawierają domeny PR, RT i IN. Cząsteczki poliproteiny Gag-Pol są również syntetyzowane na wolnych polibosomach i transportowane do błony komórkowej. Poliproteina Prl60Gagpol zawiera wszystkie miejsca międzycząsteczkowych oddziaływań właściwych dla polipagoteiny Gag i miejsc wiązania błon. W związku z tym, cząsteczki poliproteinę gag-pol, fuzji z błoną, a wraz z gag cząsteczki zawierające wiriony formowania, co może prowadzić do rozpoczyna aktywną proteazę i wirion proces dojrzewania. Proteaza HIV-1 jest wysoce aktywna tylko w postaci dimeru, dlatego też w celu samo-wycięcia z Prl60Gag-Pol wymagana jest dimeryzacja tych cząsteczek. Dojrzewanie wirionu polega na tym, że uwolniona aktywna proteaza odcina prl60Gag-Pol i Gag55 w rozpoznawalne miejsca; powstają białka p17, p24, p7, p6, revertaza, integraza i ich związek ze strukturą wirusa.
Białka env jest syntetyzowany na rybosomach związanych z błony retikulum endoplazmatycznego, glikozylowane, a następnie tnie się ją na proteazy komórkowe gp120 i gp41 i jest transportowany do powierzchni komórki. W tym przypadku gp41 przenika przez błonę i wiąże się z domenami macierzy cząsteczki białka Gag związanej z wewnętrzną powierzchnią błony. Związek ten utrzymuje się w dojrzałym wirionie.
Tak więc, montaż wirusowych cząsteczek jest agregacja białek prekursorowych i pokrewnych cząsteczek RNA na błonie komórki gospodarza, tworzenie wirionów niedojrzałych i ich uwolnienia przez pączkowanie z powierzchni komórki. Podczas pączkowania wirion otacza się błoną komórkową, w której osadzone są cząsteczki gp41 i gp120. Podczas pączkowania lub ewentualnie po uwolnieniu wirionów dojrzewania następuje, co odbywa się z użyciem proteazy wirusa cięcia proteolitycznego białek prekursorowych Pr55Gag i wirus Prl60Gag-Pol do postaci dojrzałej białka, i ich skojarzenia do poszczególnych zespołów konstrukcyjnych. Wiodąca rola w morfogenezy wirusa odgrywa prekursora poliproteiny Pr55Gag, która organizuje i montuje niedojrzałą wirion; Proces dojrzewania jest zakończony przez specyficzną wirusową proteazę.
Przyczyny niedoboru odporności
Jedną z głównych przyczyn niedoboru odporności w zakażeniu HIV jest masowa śmierć pomocników T. Występuje z powodu następujących zdarzeń. Po pierwsze, wirusy T pomagające zainfekowane wirusem umierają z powodu apoptozy. Uważa się, że pacjenci z replikacji wirusa AIDS, apoptozę i zmniejszeniem liczby komórek T pomocniczych są ze sobą połączone. Po drugie, limfocyty T zabójcy rozpoznawania i niszczenia komórek T zainfekowanych wirusem, lub które posiadają cząsteczki zaadsorbowane gpl20, jak i limfocytów T pomocniczych zakażonych wirusem zakażonych wirusem i, które tworzą symplasts (syncytiów) składający się z kilkudziesięciu komórek (część umierają w wyniku rozmnażania się w nich wirusów). Z powodu zniszczenia dużej ilości komórek pomocniczych T zachodzi ekspresja receptora błony spadek liczby limfocytów B, z IL-2, zaburzenia syntezy różnych interleukin (czynnik wzrostu i różnicowania limfocytów B -, IL-4, IL-5, IL-6 i inne) w wyniku czego naruszona zostaje funkcja systemu T-killer. Następuje hamowanie aktywności układu dopełniacza i makrofagów. Zakażonych wirusem makrofagi i monocyty chcieli umrzeć, ale nie są w stanie usunąć wirusa z organizmu. W końcu, ze względu na strukturalne podobieństwo antygenowe i gpl20 niektóre z receptorami komórek nabłonkowych z organizmu (w tym trofoblasty pośredniczenia z receptorem przenoszeniu HIV przeszczepu) syntezuje antiretseptornyh przeciwciał o szerokim spektrum działania. Takie przeciwciała mogą blokować różne receptory komórkowe i komplikować przebieg choroby z zaburzeniami autoimmunologicznymi. Konsekwencją zakażenia HIV jest porażka wszystkich głównych części układu odpornościowego. Tacy pacjenci stają się bezbronni wobec wielu różnych mikroorganizmów. Prowadzi to do rozwoju oportunistycznych infekcji i chorób nowotworowych. Dla pacjentów zakażonych HIV są na zwiększone ryzyko zachorowania na raka, z co najmniej trzech typów mięsaka Kaposiego; rak (w tym rak skóry); Chłoniak z komórek B powstający w wyniku złośliwej degeneracji limfocytów B. Jednak HIV ma nie tylko limfocyty, ale także neurotropię. Wnika w OUN komórek (astrocyty) albo endocytozy za pośrednictwem receptora i fagocytozy astrocytów z limfoblastów zakażonych wirusem. W oddziaływaniu wirus z astrocytów są utworzone symplasts prowadzące do rozprzestrzeniania się patogenu międzykomórkowych kanałów. W makrofagów i monocytów, wirus może się utrzymywać przez dłuższy czas, a więc służyć jako zbiornik i jego dystrybutorów w organizmie, jest w stanie przeniknąć do wszystkich tkanek. Zainfekowane makrofagi odgrywają główną rolę w migracji HIV w ośrodkowym układzie nerwowym i jego klęsce. U 10% pacjentów z pierwotnym zespołów klinicznych związanych z OUN i przedstawionych postaci demencji (demencja). Tak więc, dla osób dotkniętych zakażeniem HIV charakteryzuje 3 grup chorób - oportunistycznych infekcji, chorób nowotworowych i OUN.
Epidemiologia zakażenia HIV
Źródłem zakażenia HIV jest tylko osoba - chory lub nosiciel wirusów. Ludzki wirus upośledzenia odporności (HIV) znajduje się we krwi, nasieniu, płynie szyjnym; u matek karmiących - w mleku matki. Zakażenie odbywa się drogą płciową, poprzez krew i jej leki, a także z matki na dziecko przed porodem, podczas porodu i po nim. Przypadki zakażenia wirusem przez pokarm, napoje i ugryzienia przez owady nie są znane.
Narkomania przyczynia się do szerzenia się AIDS. Zakażenie HIV wzrasta z każdym rokiem. Według danych WHO w latach 1980-2000 zakażono wirusem HIV 58 milionów ludzi. Dopiero w 2000 r. 5,3 miliona ludzi zostało zarażonych na świecie, a 3 miliony ludzi zmarło na AIDS. W Rosji od 1 stycznia 2004 r. Zarejestrowanych było 264 000 osób zakażonych wirusem HIV. Połowa osób zarażonych wirusem HIV umiera w ciągu 11-12 lat od zakażenia. Na początku 2004 r. Na każde 100 000 rosyjskich obywateli około 180 żyło z rozpoznaniem "zakażenia HIV". Przewiduje się, że na tym poziomie zapadalności całkowita liczba osób zakażonych wirusem HIV w Rosji do 2012 roku wyniesie 2,5-3 miliona osób. Złożoność walki z zakażeniem wirusem HIV zależy od wielu powodów: po pierwsze, nie istnieją skuteczne metody leczenia i profilaktyki; Po drugie, okres inkubacji zakażenia wirusem HIV może przekroczyć 10 lat. Czas jego działania zależy od momentu aktywacji limfocytu T i DNA-prowirusa zawartego w jego chromosomie. Nie jest jeszcze jasne, czy każdy wirus zakażony AIDS jest skazany na zagładę, czy też może mieć długotrwały wirus bez choroby (co wydaje się mało prawdopodobne). Wreszcie, istnieje kilka ludzkich wirusów niedoboru odporności (HIV-1, HIV-2), różnic antygenowych, które zapobiegają tworzeniu odporności krzyżowej. Wykrywanie wirusa niedoboru odporności małp (SIV) rzuca światło na pochodzenie HIV. SIO do organizowania genomu jest podobne do HIV, ale różni się znacznie w sekwencji nukleotydów. HIV-2 serologicznie zajmuje pozycję pośrednią między HIV-1 i SIV, a sekwencja nukleotydów jest bliższa SIV. W związku z tym VM Żdanow zasugerował, że wirusy HIV-1, HIV-2 i SIV pochodzą od wspólnego przodka. Jest to możliwe, według R. Gallo, jednego z SIV jakoś dostał się do organizmu ludzkiego, który został poddany liczbę mutacji, które powodowało żadnej HIV-1, HIV-2 i jego inne formy.
Objawy zakażenia wirusem HIV
Wirus ludzkiego niedoboru odporności charakteryzuje się pewnymi cechami, na które w dużej mierze zależy patogeneza choroby. Wirus ma bardzo wysoki wskaźnik rozmnażania, określony przez jego elementy regulatorowe (5000 wirionów syntetyzuje się w fazie aktywnej w ciągu 5 minut). Ze względu na obecność białka fuzyjnego (gp41), wirus indukuje tworzenie rozległych struktur syncytialnych w wyniku fuzji zakażonych i niezakażonych pomocników T, co skutkuje ich masową śmiercią. Molekuły o dużej cząsteczce gpl20 swobodnie krążą we krwi i wiążą się z receptorami niezakażonych T-pomocników, w wyniku czego są rozpoznawane i niszczone przez zabójców T. Wirus może rozprzestrzeniać się przez kanały międzykomórkowe z komórki do komórki, w tym przypadku staje się on mniej dostępny dla przeciwciał.
Kryteria kliniczne zakażenia HIV
Dorosłych HIV ustalenia, czy posiadają co najmniej dwie poważne objawy, w połączeniu z co najmniej jednego objawu niewielka w nieobecności innych znanych przyczyn upośledzenia odporności (rak, wrodzonej odporności, ciężką głodu, i tak dalej. G). Poważne objawy to:
- utrata masy ciała o 10% lub więcej;
- długotrwała gorączka, przerywana lub uporczywa;
- przewlekła biegunka.
Drobne objawy: uporczywy kaszel, uogólnione zapalenie skóry, nawracające półpasiec, kandydoza jamy ustnej i gardła, przewlekła opryszczka pospolita, uogólniona limfadenopatia. Rozpoznanie AIDS odbywa się z obecnością tylko mięsaka Kaposiego, kryptokokowego zapalenia opon mózgowych, pneumocystycznego zapalenia płuc. Na kliniczny obraz choroby ma wpływ infekcja oportunistyczna.
Metody hodowli ludzkiego wirusa upośledzenia odporności (HIV)
HIV-1 i HIV-2 można hodować w komórkach tylko jednego klonu limfocytów TCB4 - H9, uzyskanych z białaczkowych limfocytów TCV4. Do tych samych celów można również stosować monowarstwowe hodowle komórek astrocytów, w których HIV-1 mnoży się dobrze. Od zwierząt po podatne na HIV-1 szympansy.
Opór wirusa w środowisku zewnętrznym jest niski. Umiera pod wpływem promieni słonecznych i promieniowania UV, ulega zniszczeniu w temperaturze 80 ° C przez 30 minut, po potraktowaniu powszechnie stosowanymi środkami dezynfekcyjnymi - przez 20-30 minut. Aby zdezynfekować materiał zawierający wirusy, konieczne jest użycie mykobakteriobójczych środków dezynfekujących, ponieważ są skuteczne w zwalczaniu mikroorganizmów o najwyższej oporności.
Diagnostyka laboratoryjna zakażenia HIV
Głównym sposobem diagnozowania wirusa i zakażenia HIV jest immunoenzymatyczna metoda enzymatyczna. Jednakże, ze względu na fakt, że gpl20 ma podobieństwa strukturalnego i antygenowe do receptorów w pewnych komórkach ludzkich, w tym, receptorów, które realizują transport immunoglobulin przez komórki nabłonka błony śluzowej w organizmie, mogą pojawić się przeciwciał związanych przeciwciał przeciwko gpl20. W takim przypadku wyniki IFM mogą być fałszywie dodatnie. Dlatego wszystkie surowice reagujące dodatnio badanych poddaje się dodatkowej analizie metodą immunoblot lub western blotting. Ta metoda opiera się na identyfikacji przeciwciał, które mają być badane po rozdzieleniu elektroforetycznym, a następnie testowaniu za pomocą znakowanych przeciwciał antywirusowych. Metoda wirusologiczna jest mało przydatna ze względu na złożoność kultury wirusa. Klon limfocytów H9 stosuje się do uzyskania antygenów wirusowych - niezbędnych składników diagnostycznych układów testowych. Metoda CDR umożliwia wykrycie wirusa już we wczesnym stadium wiremii.
Leczenie zakażenia HIV
Konieczne jest znalezienie lub synteza leków, które skutecznie hamują aktywność odwrotnej transkryptazy (revertazy) lub wirusowej proteazy. Zapobiegną tworzeniu się DNA-prowirusa i (lub) hamują wewnątrzkomórkowe namnażanie wirusa. Obecna strategia leczenia osób zakażonych wirusem HIV opiera się na zasadzie łączonego stosowania leków hamujących wirusową proteazę (jeden z leków) i rewersji (2 różnych leków), połączonej (potrójnej) terapii. W Rosji do leczenia osób zakażonych wirusem HIV zaleca się stosowanie dwóch leków do domu: fosfiazydu i crixivanu, szczególnie hamujących reprodukcję wirusa HIV we wczesnych i późnych stadiach reprodukcji, szczególnie o zmniejszonej aktywności azydotymidyny.
Problem specyficznej prewencji polega na stworzeniu szczepionki, która zapewniłaby tworzenie skutecznej odporności komórkowej opartej na cytotoksycznych limfocytach swoistych dla wirusa, bez jakiejkolwiek znaczącej produkcji przeciwciał. Taką odporność zapewniają pomocnicy Thl. Jest możliwe, że przeciwciała, w tym neutralizujące wirusy, są nie tylko nieskuteczne w tłumieniu infekcji HIV, ale na wysokim poziomie hamują odporność komórkową. Dlatego szczepionka przeciw wirusowi HIV powinna przede wszystkim spełniać dwa podstawowe wymagania: a) być absolutnie bezpieczna i b) stymulować aktywność limfocytów T-cytotoksycznych. Badano skuteczność różnych wariantów szczepionek otrzymanych z zabitych (inaktywowanych) wirusów i poszczególnych antygenów o wysokich właściwościach ochronnych. Takie antygeny można albo wyizolować z samych wirionów, albo zsyntetyzować chemicznie. Zaproponowano szczepionkę opartą na metodach inżynierii genetycznej. Jest to rekombinowany wirus krowianki, który przenosi geny HIV odpowiedzialne za syntezę antygenów o silnych właściwościach immunogennych. Decyzja o skuteczności tych szczepionek wymaga znacznego czasu ze względu na długi czas trwania okresu inkubacji zakażenia HIV i dużą zmienność patogenu. Stworzenie wysoce skutecznej szczepionki przeciw HIV jest pilnie podstawowym problemem.


 [
[