Ekspert medyczny artykułu
Nowe publikacje
Cewnikowanie serca
Ostatnia recenzja: 06.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
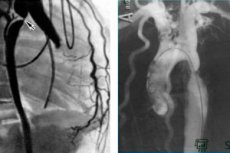
Cewnikowanie jam serca wykonuje się poprzez nakłucie i przezskórne wprowadzenie cewnika do naczynia - żyły obwodowej (łokciowej, podobojczykowej, szyjnej, udowej) w przypadku prawych komór serca lub tętnicy (ramiennej, udowej, pachowej, promieniowej) w przypadku lewych komór serca.
Metodyka wykonywania cewnikowania serca
W przypadku poważnego zwężenia zastawki aortalnej lub jej sztucznej protezy, gdy nie można wstecznie wprowadzić cewnika do lewej komory, stosuje się transseptalne nakłucie przegrody międzyprzedsionkowej z prawego przedsionka do lewego, a następnie do lewej komory. Najczęściej stosowanym podejściem do naczynia jest metoda Seldingera (1953). Po miejscowym znieczuleniu skóry i tkanki podskórnej 0,5-1% roztworem nowokainy lub 2% roztworem lidokainy i niewielkim nacięciu na skórze, żyłę lub tętnicę nakłuwa się igłą; gdy z proksymalnego końca igły (pawilonu) pojawi się krew (należy spróbować nakłuć tylko przednią ścianę naczynia), przez igłę wprowadza się prowadnik, igłę usuwa się i cewnik wprowadza się do naczynia wzdłuż prowadnika, który oczywiście powinien być dłuższy od cewnika. Cewnik jest przesuwany do wymaganego miejsca pod kontrolą rentgenowską. W przypadku stosowania pływających cewników typu Swan-Gans z balonem na końcu, położenie końcówki cewnika jest określone przez krzywą ciśnienia. Preferowane jest zainstalowanie cienkościennego introduktora z zaworem hemostatycznym i boczną odgałęzieniem do płukania do naczynia, przez które łatwo jest wprowadzić cewnik i w razie potrzeby wymienić go na inny. Cewnik i introduktor są przemywane heparynizowanym izotonicznym roztworem chlorku sodu, aby zapobiec tworzeniu się skrzepu. Używając różnych typów cewników, można dotrzeć do różnych części serca i naczyń, zmierzyć w nich ciśnienie, pobrać próbki krwi do oksymetrii i innych badań, wprowadzić RVC w celu określenia parametrów anatomicznych, zwężeń, wydzieliny krwi itp.
Jeśli nie ma kontroli fluoroskopowej (rentgenowskiej) nad położeniem cewnika, stosuje się cewniki z nadmuchiwanym, pływającym balonem na końcu, który może poruszać się wraz z przepływem krwi do prawego przedsionka, prawej komory, tętnicy płucnej i rejestrować w nich ciśnienie. Ciśnienie klinowe tętnicy płucnej pozwala pośrednio ocenić stan funkcji lewej komory, jej ciśnienie końcoworozkurczowe (EDP), ponieważ lewokomorowe EDP jest średnim ciśnieniem w lewym przedsionku lub ciśnieniem w naczyniach włosowatych płucnych. Jest to ważne dla monitorowania terapii w przypadkach niedociśnienia, niewydolności serca, na przykład w ostrym zawale mięśnia sercowego. Jeśli cewnik ma dodatkowe urządzenia, można zmierzyć rzut serca za pomocą rozcieńczenia barwnika lub termodylucji, zarejestrować elektrogram wewnątrzkomorowy i wykonać stymulację wsierdzia. Krzywe ciśnienia wewnątrzkomorowego rejestruje się za pomocą czujnika ciśnienia cieczy Statham i EKG na rejestratorze strumieniowym lub komputerze z możliwością wydruku na papierze; ich zmiany można wykorzystać do oceny konkretnej patologii serca.
Pomiar rzutu serca
Należy zauważyć, że nie ma absolutnie dokładnych metod pomiaru rzutu serca. Podczas cewnikowania serca najczęściej stosuje się trzy metody określania rzutu serca: metodę Ficka, metodę termodylucji i metodę angiograficzną.
Metoda Ficka
Została zaproponowana przez Adolpha Ficka w 1870 roku. Metoda opiera się na założeniu, że w stanie spoczynku dopływ tlenu do płuc jest równy ilości tlenu wykorzystywanego przez tkanki, a ilość krwi wyrzucanej przez lewą komorę jest równa objętości krwi przepływającej przez płuca. Należy pobrać mieszaną krew żylną, ponieważ stężenie tlenu we krwi żyły głównej i zatoki wieńcowej różni się znacząco. Krew pobiera się z prawej komory lub tętnicy płucnej, co jest lepsze. Różnicę tętniczo-żylną tlenu można określić na podstawie stężenia tlenu we krwi tętniczej (Ca) i żylnej (Cv). Obliczając zawartość tlenu pochłoniętego w ciągu 1 minuty, można obliczyć objętość krwi przepływającej przez płuca w tym samym okresie czasu, tj. rzut serca (CO):
MO = Q / Ca - St (l/min),
Gdzie Q oznacza absorpcję tlenu przez organizm (ml/min).
Znając indeks sercowy, możesz obliczyć indeks sercowy (CI). Aby to zrobić, podziel indeks sercowy przez powierzchnię żelu pacjenta, która jest obliczana na podstawie jego wzrostu i masy ciała. Indeks sercowy u osoby dorosłej wynosi normalnie 5-6 l/min, a CI wynosi 2,8-3,5 l/min/ m2.
Metoda termodylucji
Metoda ta wykorzystuje schłodzony izotoniczny roztwór chlorku sodu (5-10 ml), który wprowadza się przez wielokanałowy cewnik do prawego przedsionka, końcówka cewnika z termistorem znajduje się w tętnicy płucnej. Kalibracja krzywych odbywa się poprzez krótkotrwałe włączenie stałego oporu, który daje odchylenia urządzenia rejestrującego odpowiadające pewnej zmianie temperatury dla danego termistora. Większość urządzeń do termodylucji jest wyposażona w analogowe urządzenia obliczeniowe. Nowoczesny sprzęt pozwala na wykonanie do 3 pomiarów MO krwi w ciągu 1 minuty i wielokrotne powtórzenie badań. Rzut serca, czyli MO, określa się według następującego wzoru: MO = V (T1 - T2) x 60 x 1,08 / S (l/min),
Gdzie V jest objętością wprowadzonego wskaźnika; T1 jest temperaturą krwi; T2 jest temperaturą wskaźnika; S jest polem pod krzywą rozcieńczenia; 1,08 jest współczynnikiem zależnym od gęstości właściwej i pojemności cieplnej krwi i izotonicznego roztworu chlorku sodu.
Zalety termodylucji oraz konieczność cewnikowania wyłącznie łożyska żylnego sprawiają, że jest to obecnie najbardziej akceptowalna metoda określania rzutu serca w praktyce klinicznej.
Niektóre aspekty techniczne laboratorium cewnikowania
Personel pracowni angiografii cewnikowej obejmuje kierownika, lekarzy, pielęgniarki operacyjne i techników rentgenowskich (RTG), jeśli stosuje się filmowanie rentgenowskie w formacie kinowym i wielkoformatowym. W laboratoriach stosujących wyłącznie filmy wideo i komputerowe rejestrowanie obrazu technicy rentgenowscy nie są potrzebni. Cały personel laboratorium musi być biegły w technikach resuscytacji krążeniowo-oddechowej, do czego sala operacyjna rentgenowska musi być wyposażona w odpowiednie leki, defibrylator, urządzenie do elektrycznej stymulacji serca z zestawem cewników elektrodowych, centralne zaopatrzenie w tlen i (najlepiej) aparat do sztucznej wentylacji płuc.
Skomplikowane i ryzykowne procedury diagnostyczne i PCI (angioplastyka, stentowanie, aterektomia itp.) powinny być wykonywane w klinikach z zespołem kardiochirurgicznym. Zgodnie z zaleceniami American College of Cardiology/American Heart Association, angioplastyka i badanie pacjentów z wysokim ryzykiem powikłań, AMI mogą być wykonywane przez doświadczonych, wykwalifikowanych specjalistów bez obecności wsparcia kardiochirurgicznego w szpitalu, jeśli pacjenta nie można przetransportować do bardziej odpowiedniego miejsca bez dodatkowego ryzyka. W Europie i niektórych innych krajach (w tym w Rosji) interwencje wewnątrznaczyniowe są coraz częściej wykonywane bez obecności kardiochirurgów, ponieważ zapotrzebowanie na pilną operację kardiochirurgiczną jest obecnie wyjątkowo niskie. Umowa z pobliską kliniką kardiochirurgii jest wystarczająca do pilnego przeniesienia pacjenta tam w przypadku powikłań około- i pooperacyjnych.
Aby utrzymać sprawność, kwalifikacje i umiejętności operatorów, laboratorium musi wykonywać co najmniej 300 procedur rocznie, a każdy lekarz musi wykonywać co najmniej 150 procedur diagnostycznych rocznie. Do cewnikowania i angiografii wymagane jest urządzenie do angiografii rentgenowskiej o wysokiej rozdzielczości, system do monitorowania EKG i ciśnienia wewnątrznaczyniowego, archiwizowania i przetwarzania obrazów angiograficznych, sterylne instrumenty i różne rodzaje cewników (różne rodzaje cewników do koronarografii opisano poniżej). Urządzenie do angiografii musi być wyposażone w przystawkę do kinezyangiograficzej lub cyfrowej komputerowej akwizycji i archiwizacji obrazów, mieć możliwość uzyskiwania obrazów online, tj. natychmiast z ilościową komputerową analizą angiogramów.
Zmiany krzywych ciśnienia wewnątrzjamowego
Krzywe ciśnienia wewnątrzjamowego mogą się zmieniać w różnych stanach patologicznych. Zmiany te służą diagnostyce podczas badania pacjentów z różnymi patologiami serca.
Aby zrozumieć przyczyny zmian ciśnienia w jamach serca, konieczne jest poznanie relacji czasowych między procesami mechanicznymi i elektrycznymi zachodzącymi w trakcie cyklu pracy serca. Amplituda fali a w prawym przedsionku jest wyższa niż amplituda fali y. Nadmiar fali y nad falą a na krzywej ciśnienia z prawego przedsionka wskazuje na naruszenie napełniania przedsionka podczas skurczu komór, co występuje w przypadku niedomykalności zastawki trójdzielnej lub jej wady.
W zwężeniu zastawki trójdzielnej krzywa ciśnienia w prawym przedsionku przypomina tę w lewym przedsionku w zwężeniu zastawki mitralnej lub zaciskającym zapaleniu osierdzia, ze spadkiem i plateau w środkowym i późnym rozkurczu, typowym dla podwyższonego ciśnienia w czasie wczesnego skurczu. Średnie ciśnienie w lewym przedsionku odpowiada dość ściśle ciśnieniu zaklinowania tętnicy płucnej i ciśnieniu rozkurczowemu pnia płucnego. W niedomykalności zastawki mitralnej bez zwężenia występuje szybki spadek ciśnienia na początku skurczu (spadek fali Y), po którym następuje stopniowy wzrost późnego rozkurczu (diastaza). Odzwierciedla to osiągnięcie równowagi między ciśnieniem przedsionkowym i komorowym w późnej fazie napełniania komór. Natomiast u pacjentów ze zwężeniem zastawki mitralnej fala y zmniejsza się powoli, podczas gdy ciśnienie w lewym przedsionku nadal zmniejsza się w trakcie rozkurczu, a nie ma oznak rozejścia się ciśnienia tętna w lewym przedsionku, ponieważ gradient ciśnienia przedsionkowo-komorowego jest zachowany. Jeśli zwężeniu zastawki mitralnej towarzyszy prawidłowy rytm zatokowy, fala α w lewym przedsionku jest zachowana, a skurcz przedsionków powoduje powstanie dużego gradientu ciśnienia. U pacjentów z izolowaną niedomykalnością zastawki mitralnej fala v jest wyraźnie wyrażona i ma strome opadające kolano linii y.
Na krzywej ciśnienia lewej komory punkt EDP bezpośrednio poprzedza początek jej skurczu izometrycznego i znajduje się bezpośrednio po fali a przed falą c ciśnienia lewego przedsionka. EDP lewej komory może wzrosnąć w następujących przypadkach: niewydolność serca, jeśli komora doświadcza dużego obciążenia spowodowanego nadmiernym przepływem krwi, na przykład w niedomykalności aorty lub zastawki mitralnej; przerost lewej komory, któremu towarzyszy zmniejszenie jej rozciągliwości, elastyczności i podatności; kardiomiopatia restrykcyjna; zaciskające zapalenie osierdzia; tamponada serca spowodowana wysiękiem osierdziowym.
W zwężeniu zastawki aortalnej, któremu towarzyszy utrudniony odpływ krwi z lewej komory i wzrost w niej ciśnienia w porównaniu do ciśnienia skurczowego w aorcie, czyli pojawienie się gradientu ciśnienia, krzywa ciśnienia w lewej komorze przypomina krzywą ciśnienia podczas skurczu izometrycznego. Jej zarysy są bardziej symetryczne, a maksymalne ciśnienie rozwija się później niż u osób zdrowych. Podobny obraz obserwuje się przy rejestrowaniu ciśnienia w prawej komorze u pacjentów ze zwężeniem tętnicy płucnej. Krzywe ciśnienia krwi mogą się również różnić u pacjentów z różnymi typami zwężenia aorty. Tak więc w zwężeniu zastawkowym obserwuje się powolny i opóźniony wzrost fali tętna tętniczego, a w kardiomiopatii przerostowej początkowy gwałtowny wzrost ciśnienia zostaje zastąpiony szybkim spadkiem, a następnie wtórną falą dodatnią odzwierciedlającą niedrożność w czasie skurczu.
Pochodne wskaźniki ciśnienia śródkomorowego
Szybkość zmiany/wzrostu krzywej ciśnienia śródkomorowego w fazie skurczu izowolumetrycznego nazywa się pierwszą pochodną - dр/dt. Wcześniej była ona wykorzystywana do oceny kurczliwości mięśnia sercowego komór. Wartość dр/dt i druga pochodna - dр/dt/р - są obliczane z krzywej ciśnienia śródkomorowego przy użyciu technologii elektronicznej i komputerowej. Maksymalne wartości tych wskaźników stanowią wskaźniki częstości skurczów komór i pomagają ocenić kurczliwość i stan inotropowy serca. Niestety, szeroki zakres tych wskaźników u różnych kategorii pacjentów nie pozwala na opracowanie jakichkolwiek średnich standardów, ale są one całkiem przydatne u jednego pacjenta z danymi początkowymi i na tle stosowania leków poprawiających funkcję kurczliwą mięśnia sercowego.
Mając obecnie w arsenale takich metod badania pacjentów, jak echokardiografia w różnych jej modyfikacjach, obrazowanie komputerowe (TK), wiązką elektronów i obrazowanie metodą rezonansu magnetycznego (MRI), wskaźniki te nie mają już tak dużego znaczenia w diagnostyce patologii serca, jak kiedyś.
Powikłania cewnikowania serca
Kardiocewnikowanie jest stosunkowo bezpieczne, jednak jak każda technika inwazyjna, ma pewien procent powikłań związanych zarówno z samą interwencją, jak i ogólnym stanem pacjenta. Zastosowanie bardziej zaawansowanych i cienkich cewników atraumatycznych, niskoosmotycznych i/lub niejonowych RVS, nowoczesnych jednostek angiograficznych z przetwarzaniem obrazu komputerowego w czasie rzeczywistym w przypadku interwencji inwazyjnych znacznie zmniejszyło częstość występowania możliwych powikłań. Tak więc śmiertelność podczas kardiocewnikowania w dużych laboratoriach angiograficznych nie przekracza 0,1%. S. Pepine i in. podają ogólny wskaźnik śmiertelności do 0,14%, przy czym 1,75% dla pacjentów poniżej 1 roku życia, 0,25% dla osób powyżej 60 roku życia, 0,03% dla choroby tętnic wieńcowych jednonaczyniowych, 0,16% dla choroby trzech naczyń i 0,86% dla choroby tętnicy wieńcowej lewej. W przypadku niewydolności serca śmiertelność wzrasta również w zależności od klasy NUHA: w I-II FC - 0,02%, III i IV FC - odpowiednio 0,12 i 0,67%. U niektórych pacjentów wzrasta ryzyko poważnych powikłań. Są to pacjenci z niestabilną i postępującą dusznicą bolesną, niedawnym (mniej niż 7 dni) zawałem mięśnia sercowego, objawami obrzęku płuc z powodu niedokrwienia mięśnia sercowego, z niewydolnością krążenia III-IV FC, ciężką niewydolnością prawej komory, wadami zastawkowymi serca (ciężkie zwężenie aorty i niedomykalność aorty z ciśnieniem tętna powyżej 80 mm Hg), wrodzonymi wadami serca z nadciśnieniem płucnym i niewydolnością prawej komory.
W wieloczynnikowej analizie 58 332 pacjentów, czynnikami prognostycznymi poważnych powikłań były ciężka zastoinowa niewydolność serca, nadciśnienie, CHD, choroba zastawki aortalnej i mitralnej, niewydolność nerek, niestabilna dusznica bolesna i ostry zawał mięśnia sercowego w ciągu pierwszych 24 godzin oraz kardiomiopatia. U 80-letnich pacjentów śmiertelność podczas inwazyjnych procedur diagnostycznych wzrosła również do 0,8%, a częstość występowania powikłań naczyniowych w miejscu nakłucia osiągnęła 5%.


 [
[