Ekspert medyczny artykułu
Nowe publikacje
Elektromiografia igłowa
Ostatnia recenzja: 06.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Do elektromiografii igłowej zalicza się następujące główne metody:
- standardowa igłowa EMG;
- Pojedyncze włókno mięśniowe EMG;
- makroEMG;
- skanowanie EMG.
Standardowa elektromiografia igłowa
Elektromiografia igłowa jest inwazyjną metodą badania, przeprowadzaną za pomocą koncentrycznej elektrody igłowej wprowadzonej do mięśnia. Elektromiografia igłowa pozwala ocenić obwodowy aparat neuromotoryczny: organizację morfofunkcjonalną jednostek ruchowych mięśni szkieletowych, stan włókien mięśniowych (ich spontaniczną aktywność), a w przypadku obserwacji dynamicznej - ocenić skuteczność leczenia, dynamikę procesu patologicznego i rokowanie choroby.
Wartość diagnostyczna
Standardowa elektromiografia igłowa zajmuje centralne miejsce wśród elektrofizjologicznych metod badawczych w różnych chorobach nerwowo-mięśniowych i ma decydujące znaczenie w różnicowaniu chorób neurogennych i pierwotnych chorób mięśni.
Metodę tę stosuje się w celu określenia stopnia odnerwienia mięśnia unerwionego przez uszkodzony nerw, stopnia jego regeneracji oraz skuteczności reinerwacji.
Elektromiografia igłowa znalazła zastosowanie nie tylko w neurologii, ale także w reumatologii, endokrynologii, medycynie sportowej i pracy, pediatrii, urologii, ginekologii, chirurgii i neurochirurgii, okulistyce, stomatologii i chirurgii szczękowo-twarzowej, ortopedii i wielu innych dziedzinach medycyny.
Wskazania do zabiegu
Choroby neuronów ruchowych rdzenia kręgowego ( SLA, zaniki mięśni rdzeniowych, polio i zespół post-polio, jamistość rdzenia itp.), mielopatie, radikulopatie, różnego rodzaju neuropatie (aksonalne i demielinizacyjne), miopatie, choroby zapalne mięśni ( zapalenie wielomięśniowe i skórno-mięśniowe ), ośrodkowe zaburzenia ruchu, zaburzenia zwieraczy i szereg innych sytuacji, kiedy zachodzi potrzeba obiektywnej oceny stanu funkcji motorycznych i układu sterowania ruchem, oceny zaangażowania w proces różnych struktur obwodowego aparatu neuromotorycznego.
 [ 6 ]
[ 6 ]
Przygotowanie
Pacjent nie potrzebuje specjalnego przygotowania do badania. Elektromiografia igłowa wymaga całkowitego rozluźnienia badanych mięśni, dlatego wykonuje się ją w pozycji leżącej. Pacjent jest wystawiany na działanie badanych mięśni, kładziony na plecach (lub brzuchu) na wygodnej miękkiej kanapie z regulowanym zagłówkiem, informowany o zbliżającym się badaniu i wyjaśniany, jak powinien napinać, a następnie rozluźniać mięsień.
 [ 7 ]
[ 7 ]
Technika elektromiografia igłowa
Badanie przeprowadza się za pomocą koncentrycznej elektrody igłowej wszczepianej w punkt motoryczny mięśnia (dopuszczalny promień nie przekracza 1 cm dla dużych mięśni i 0,5 cm dla małych). Rejestruje się potencjały MU (PMU). Wybierając PMU do analizy, należy przestrzegać pewnych zasad ich doboru.
Wielorazowe elektrody igłowe są wstępnie sterylizowane w autoklawie lub innymi metodami sterylizacji. Jednorazowe sterylne elektrody igłowe są otwierane bezpośrednio przed badaniem mięśni.
Po wszczepieniu elektrody do całkowicie rozluźnionego mięśnia i za każdym razem, gdy jest on poruszany, monitoruje się ewentualne pojawienie się spontanicznej aktywności. PMU jest rejestrowane przy minimalnym dowolnym napięciu mięśni, co pozwala na identyfikację poszczególnych PMU. Wybiera się 20 różnych PMU, obserwując określoną sekwencję ruchów elektrody w mięśniu.
Oceniając stan mięśni, przeprowadza się ilościową analizę wykrytej aktywności spontanicznej, co jest szczególnie ważne przy monitorowaniu stanu pacjenta w czasie, a także przy określaniu skuteczności terapii. Analizuje się parametry rejestrowanych potencjałów różnych jednostek ruchowych.
Elektromiografia igłowa w chorobach synaptycznych
W chorobach synaptycznych elektromiografia igłowa jest uważana za dodatkową metodę badania. W miastenii pozwala ocenić stopień „zablokowania” włókien mięśniowych w MU, określany stopniem zmniejszenia średniego czasu trwania MU w badanych mięśniach. Jednak głównym celem elektromiografii igłowej w miastenii jest wykluczenie ewentualnej współistniejącej patologii (zapalenie wielomięśniowe, miopatia, zaburzenia endokrynologiczne, różne polineuropatie itp.). Elektromiografia igłowa u pacjentów z miastenią jest również stosowana w celu określenia stopnia odpowiedzi na wprowadzenie leków antycholinesterazowych, czyli oceny zmiany parametrów MU przy podaniu neostygminy metylosiarczanu (proseryny). Po wprowadzeniu leku czas trwania MU w większości przypadków wydłuża się. Brak reakcji może wskazywać na tzw. miopatię miasteniczną.
Główne kryteria elektromiograficzne chorób synaptycznych:
- skrócenie średniego czasu trwania PDE;
- zmniejszenie amplitudy poszczególnych PMU (może nie występować);
- umiarkowana polifazja PDE (może być nieobecna);
- brak spontanicznej aktywności lub obecność jedynie izolowanego PF.
W miastenii średni czas trwania MUAP jest zwykle nieznacznie skrócony (o 10-35%). Większość MUAP ma normalną amplitudę, ale w każdym mięśniu rejestruje się kilka MUAP o zmniejszonej amplitudzie i czasie trwania. Liczba polifazowych MUAP nie przekracza 15-20%. Brak jest spontanicznej aktywności. Jeśli u pacjenta zostanie wykryte wyraźne PF, należy rozważyć połączenie miastenii z niedoczynnością tarczycy, zapaleniem wielomięśniowym lub innymi chorobami.
Elektromiografia igłowa w pierwotnych chorobach mięśni
Elektromiografia igłowa jest główną metodą elektrofizjologiczną diagnozowania pierwotnych chorób mięśni (różnych miopatii). Ze względu na zmniejszoną zdolność jednostek ruchowych do rozwijania wystarczającej siły, aby utrzymać nawet minimalny wysiłek, pacjent z jakąkolwiek pierwotną patologią mięśniową musi zrekrutować dużą liczbę jednostek ruchowych. To determinuje specyfikę elektromiografii u takich pacjentów. Przy minimalnym napięciu mięśni dowolnych trudno jest wyizolować poszczególne jednostki ruchowe; na ekranie pojawia się tak wiele małych potencjałów, że uniemożliwia to ich identyfikację. Jest to tak zwany miopatyczny wzór elektromiografii.
W miopatiach zapalnych (zapaleniu wielomięśniowym) dochodzi do procesu reinerwacji, który może powodować podwyższenie parametrów MUAP.
Główne kryteria elektromiograficzne pierwotnych chorób mięśni:
- skrócenie średniego czasu trwania PDE o ponad 12%;
- zmniejszenie amplitudy poszczególnych PMU (średnia amplituda może być zmniejszona lub normalna, a czasami zwiększona);
- polifazja PDE;
- wyraźna spontaniczna aktywność włókien mięśniowych w miopatii zapalnej (zapaleniu wielomięśniowym) lub PMD (w pozostałych przypadkach jest ona minimalna lub nie występuje wcale).
Skrócenie średniego czasu trwania MUAP jest kardynalnym objawem każdej pierwotnej choroby mięśni. Powodem tej zmiany jest to, że w miopatiach włókna mięśniowe ulegają zanikowi, część z nich wypada ze składu MU z powodu martwicy, co prowadzi do zmniejszenia parametrów MUAP. Skrócenie czasu trwania większości MUAP jest wykrywane w prawie wszystkich mięśniach pacjentów z miopatiami, chociaż jest bardziej wyraźne w klinicznie najbardziej dotkniętych mięśniach proksymalnych.
Histogram rozkładu PMU według czasu trwania przesuwa się w kierunku mniejszych wartości (etap I lub II). Wyjątkiem jest PMD: ze względu na ostrą polifazję PMU, sięgającą niekiedy 100%, średni czas trwania może być znacznie wydłużony.
Elektromiografia pojedynczego włókna mięśniowego
Elektromiografia pojedynczego włókna mięśniowego pozwala na badanie aktywności elektrycznej poszczególnych włókien mięśniowych, w tym na określenie ich gęstości w jednostkach ruchowych mięśni oraz niezawodności przekazu nerwowo-mięśniowego za pomocą metody drgania.
Do przeprowadzenia badania potrzebna jest specjalna elektroda o bardzo małej powierzchni wyładowczej o średnicy 25 µm, umieszczona na jej powierzchni bocznej 3 mm od końca. Mała powierzchnia wyładowcza umożliwia rejestrację potencjałów pojedynczego włókna mięśniowego w strefie o promieniu 300 µm.
Badanie gęstości włókien mięśniowych
Określenie gęstości włókien mięśniowych w MU opiera się na fakcie, że strefa mikroelektrody do rejestrowania aktywności pojedynczego włókna mięśniowego jest ściśle określona. Miarą gęstości włókien mięśniowych w MU jest średnia liczba potencjałów pojedynczych włókien mięśniowych rejestrowanych w strefie jej rejestracji podczas badania 20 różnych MU w różnych strefach mięśnia. Zazwyczaj strefa ta może zawierać tylko jedno (rzadziej dwa) włókno mięśniowe należące do tego samego MU. Stosując specjalną technikę metodyczną (urządzenie wyzwalające), można uniknąć pojawienia się na ekranie potencjałów pojedynczych włókien mięśniowych należących do innych MU.
Średnia gęstość włókien jest mierzona w jednostkach konwencjonalnych poprzez obliczenie średniej liczby potencjałów poszczególnych włókien mięśniowych należących do różnych MU. U zdrowych osób wartość ta zmienia się w zależności od mięśnia i wieku od 1,2 do 1,8. Wzrost gęstości włókien mięśniowych w MU odzwierciedla zmianę w strukturze MU w mięśniu.
Badania nad zjawiskiem drgania
Zwykle zawsze można ustawić elektrodę do rejestrowania pojedynczego włókna mięśniowego w mięśniu tak, aby rejestrowane były potencjały dwóch sąsiednich włókien mięśniowych należących do jednej jednostki ruchowej. Jeśli potencjał pierwszego włókna zostanie aktywowany przez urządzenie wyzwalające, potencjał drugiego włókna będzie nieznacznie niedopasowany w czasie, ponieważ impuls potrzebuje różnych czasów, aby przejść przez dwa zakończenia nerwowe o różnej długości. Znajduje to odzwierciedlenie w zmienności interwału międzyszczytowego, tj. czas rejestrowania drugiego potencjału waha się w stosunku do pierwszego, definiowanego jako potencjał „taniec” lub „jitter”, którego wartość wynosi zwykle 5-50 μs.
Jitter odzwierciedla zmienność czasu transmisji nerwowo-mięśniowej w dwóch płytkach końcowych ruchowych, więc ta metoda pozwala nam badać stabilność transmisji nerwowo-mięśniowej. Gdy jest ona zaburzona przez jakąkolwiek patologię, jitter wzrasta. Jego najbardziej wyraźny wzrost obserwuje się w chorobach synaptycznych, głównie w miastenii.
W przypadku znacznego pogorszenia przewodzenia nerwowo-mięśniowego dochodzi do stanu, w którym impuls nerwowy nie może pobudzić jednego z dwóch sąsiednich włókien. Wówczas następuje tzw. zablokowanie impulsu.
W SLA obserwuje się również znaczny wzrost drżenia i niestabilności poszczególnych składników PMU. Wyjaśnia się to tym, że terminale i niedojrzałe synapsy nowo powstałe w wyniku kiełkowania działają z niewystarczającym stopniem niezawodności. W tym przypadku najbardziej wyraźne drżenie i blokowanie impulsów obserwuje się u pacjentów z szybkim postępem procesu.
Makroelektromiografia
Makroelektromiografia pozwala nam ocenić wielkość jednostek ruchowych w mięśniach szkieletowych. Podczas badania stosuje się jednocześnie dwie elektrody igłowe: specjalną makroelektrodę wszczepianą głęboko w mięsień tak, aby boczna powierzchnia odwodząca elektrody znajdowała się w grubości mięśnia, oraz regularną elektrodę koncentryczną wszczepianą pod skórę. Metoda makroelektromiografii opiera się na badaniu potencjału rejestrowanego przez makroelektrodę o dużej powierzchni odwodzącej.
Jako elektrodę odniesienia stosuje się konwencjonalną elektrodę koncentryczną, którą umieszcza się pod skórą w odległości co najmniej 30 cm od głównej makroelektrody, w strefie minimalnej aktywności badanego mięśnia, czyli możliwie najdalej od punktu ruchowego mięśnia.
Inna elektroda do rejestrowania potencjałów pojedynczych włókien mięśniowych, zamontowana w kaniuli, rejestruje potencjał włókna mięśniowego badanego MU, który służy jako wyzwalacz uśredniania makropotencjału. Sygnał z kaniuli elektrody głównej również trafia do uśredniacza. Uśrednia się 130-200 impulsów (epoka 80 ms, okres 60 ms jest używany do analizy), aż do pojawienia się stabilnej izolini i stabilnego makropotencjału amplitudy MU. Rejestracja odbywa się na dwóch kanałach: na jednym rejestrowany jest sygnał z jednego włókna mięśniowego badanego MU, który wyzwala uśrednianie, na drugim odtwarzany jest sygnał pomiędzy elektrodą główną i referencyjną.
Głównym parametrem używanym do oceny makropotencjału jednostki ruchowej jest jego amplituda, mierzona od szczytu do szczytu. Czas trwania potencjału nie ma znaczenia przy stosowaniu tej metody. Możliwe jest oszacowanie obszaru makropotencjałów jednostki ruchowej. Zwykle istnieje szeroki zakres wartości jego amplitudy, wraz z wiekiem nieco wzrasta. W chorobach neurogennych amplituda makropotencjałów jednostki ruchowej wzrasta w zależności od stopnia reinerwacji w mięśniu. W chorobach neuronalnych jest najwyższa.
W późniejszych stadiach choroby amplituda makropotencjałów MU ulega obniżeniu, zwłaszcza przy znacznym spadku siły mięśniowej, co pokrywa się ze spadkiem parametrów MU rejestrowanych w standardowej elektromiografii igłowej.
W miopatiach obserwuje się zmniejszenie amplitudy makropotencjałów jednostek ruchowych, jednak u niektórych pacjentów ich średnie wartości są prawidłowe, ale mimo to nadal obserwuje się pewną liczbę potencjałów o zmniejszonej amplitudzie. Żadne z badań, w których badano mięśnie pacjentów z miopatią, nie wykazało wzrostu średniej amplitudy makropotencjałów jednostek ruchowych.
Metoda makroelektromiografii jest bardzo pracochłonna, dlatego nie jest powszechnie stosowana w praktyce rutynowej.
Elektromiografia skaningowa
Metoda pozwala na badanie czasowego i przestrzennego rozkładu aktywności elektrycznej jednostki ruchowej poprzez skanowanie, czyli stopniowe przesuwanie elektrody w obszarze lokalizacji włókien badanej jednostki ruchowej. Elektromiografia skaningowa dostarcza informacji o przestrzennym położeniu włókien mięśniowych w całej przestrzeni jednostki ruchowej i może pośrednio wskazywać na obecność grup mięśniowych, które powstają w wyniku procesu denewacji włókien mięśniowych i ich powtarzającej się reinerwacji.
Przy minimalnym dobrowolnym napięciu mięśnia, elektroda włożona do niego w celu rejestracji pojedynczego włókna mięśniowego jest używana jako wyzwalacz, a za pomocą wyjściowej koncentrycznej elektrody igłowej (skanującej) PMU jest rejestrowany ze wszystkich stron o średnicy 50 mm. Metoda opiera się na powolnym, stopniowym zanurzaniu standardowej elektrody igłowej w mięsień, gromadzeniu informacji o zmianie parametrów potencjału określonego MU i konstruowaniu odpowiadającego obrazu na ekranie monitora. Elektromiografia skaningowa to seria oscylogramów umieszczonych jeden pod drugim, z których każdy odzwierciedla oscylacje biopotencjału rejestrowanego w danym punkcie i uchwyconego przez powierzchnię wyjściową koncentrycznej elektrody igłowej.
Późniejsza analiza komputerowa wszystkich MUAP-ów i analiza ich trójwymiarowego rozkładu pozwala na uzyskanie wglądu w profil elektrofizjologiczny neuronów ruchowych.
Podczas analizy danych elektromiografii skaningowej ocenia się liczbę głównych pików MUAP, przesunięcie ich w czasie pojawienia się, czas trwania odstępów czasu między pojawieniem się poszczególnych frakcji potencjału danej MU, a także oblicza się średnicę strefy rozmieszczenia włókien w każdej z badanych MU.
W DRP amplituda i czas trwania, a także obszar potencjalnych oscylacji w skaningowej elektromiografii, wzrastają. Jednak przekrój poprzeczny strefy rozmieszczenia włókien poszczególnych DE nie zmienia się znacząco. Liczba frakcji charakterystycznych dla danego mięśnia również nie ulega zmianie.
Przeciwwskazania do zabiegu
Praktycznie nie ma przeciwwskazań do elektromiografii igłowej. Za ograniczenie uważa się stan nieprzytomności pacjenta, kiedy nie może on dobrowolnie napinać mięśnia. Jednak nawet w tym przypadku można stwierdzić obecność lub brak aktualnego procesu w mięśniach (na podstawie obecności lub braku spontanicznej aktywności włókien mięśniowych). Elektromiografię igłową należy wykonywać ostrożnie w mięśniach, które mają wyraźne rany ropne, niegojące się owrzodzenia i głębokie oparzenia.
Normalna wydajność
DE jest strukturalnym i funkcjonalnym elementem mięśnia szkieletowego. Tworzy go neuron ruchowy zlokalizowany w przednim rogu istoty szarej rdzenia kręgowego, którego akson wyłania się jako mielinowane włókno nerwowe jako część korzenia ruchowego, oraz grupa włókien mięśniowych, które tworzą kontakt z licznymi odgałęzieniami tego aksonu, pozbawionymi osłonki mielinowej - zakończeniami, za pomocą synapsy.
Każde włókno mięśniowe mięśnia ma swój własny koniec, jest częścią tylko jednej jednostki ruchowej i ma własną synapsę. Aksony zaczynają intensywnie rozgałęziać się na poziomie kilku centymetrów przed mięśniem, aby zapewnić unerwienie każdego włókna mięśniowego, które jest częścią tej jednostki ruchowej. Neuron ruchowy generuje impuls nerwowy, który jest przesyłany wzdłuż aksonu, jest wzmacniany w synapsie i powoduje skurcz wszystkich włókien mięśniowych należących do tej jednostki ruchowej. Całkowity potencjał bioelektryczny rejestrowany podczas takiego skurczu włókien mięśniowych nazywany jest potencjałem jednostki ruchowej.
Potencjały jednostek motorycznych
Ocenę stanu jednostek motorycznych mięśni szkieletowych człowieka przeprowadza się na podstawie analizy parametrów potencjałów, które generują: czasu trwania, amplitudy i kształtu. Każda jednostka motoryczna powstaje w wyniku algebraicznego dodania potencjałów wszystkich włókien mięśniowych tworzących jednostkę motoryczną, która funkcjonuje jako pojedyncza całość.
Gdy fala wzbudzenia rozprzestrzenia się wzdłuż włókien mięśniowych w kierunku elektrody, na ekranie monitora pojawia się potencjał trójfazowy: pierwsze odchylenie jest dodatnie, następnie następuje szybki ujemny szczyt, a potencjał kończy się trzecim, również dodatnim odchyleniem. Fazy te mogą mieć różne amplitudy, czasy trwania i obszary, które zależą od tego, jak powierzchnia wyjściowa elektrody jest położona względem centralnej części rejestrowanego DE.
Parametry PMU odzwierciedlają wielkość DE, ilość, wzajemne ułożenie włókien mięśniowych i gęstość ich rozmieszczenia w każdym konkretnym DE.
Czas trwania normalnego potencjału jednostki motorycznej
Głównym parametrem PDE jest jego czas trwania, czyli długość, mierzona jako czas w milisekundach od początku odchylenia sygnału od linii środkowej do całkowitego powrotu do niej.
Czas trwania PMU u zdrowej osoby zależy od mięśnia i wieku. Z wiekiem czas trwania PMU wydłuża się. Aby stworzyć jednolite kryteria normy w badaniu PMU, opracowano specjalne tabele normalnych średnich wartości czasu trwania dla różnych mięśni osób w różnym wieku. Fragment takich tabel podano poniżej.
Miarą oceny stanu MU w mięśniu jest średni czas trwania 20 różnych MUAP rejestrowanych w różnych punktach badanego mięśnia. Średnia wartość uzyskana podczas badania jest porównywana z odpowiadającym jej wskaźnikiem przedstawionym w tabeli, a odchylenie od normy jest obliczane (w procentach). Średni czas trwania MUAP jest uważany za normalny, jeśli mieści się w granicach ±12% wartości podanej w tabeli (za granicą średni czas trwania MUAP jest uważany za normalny, jeśli mieści się w granicach ±20%).
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Czas trwania potencjałów jednostek ruchowych w patologii
Głównym wzorcem zmian czasu trwania PDE w stanach patologicznych jest jego wydłużenie w chorobach neurogennych i skrócenie w patologiach synaptycznych i pierwotnych mięśniowych.
Aby dokładniej ocenić stopień zmian PMU w mięśniach z różnymi uszkodzeniami obwodowego aparatu neuromotorycznego, dla każdego mięśnia stosuje się histogram rozkładu PMU według czasu trwania, ponieważ ich średnia wartość może mieścić się w granicach odchyleń normalnych przy oczywistej patologii mięśni. Zazwyczaj histogram ma postać rozkładu normalnego, którego maksimum pokrywa się ze średnim czasem trwania PMU dla danego mięśnia. Przy każdej patologii obwodowego aparatu neuromotorycznego kształt histogramu ulega znacznej zmianie.
Elektromiograficzne stadia procesu patologicznego
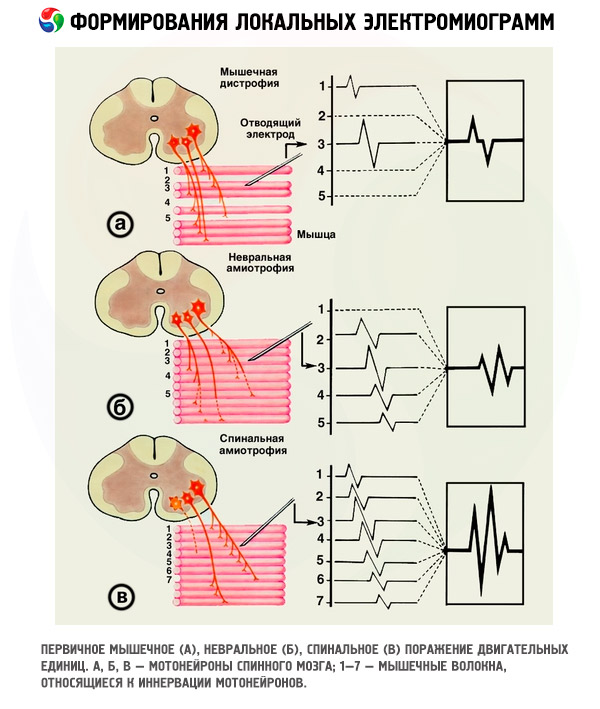
Na podstawie zmiany czasu trwania MU w chorobach neuronów ruchowych rdzenia kręgowego, kiedy wszystkie zmiany zachodzące w mięśniach można prześledzić w stosunkowo krótkim czasie, wyróżniono sześć stadiów EMG, które odzwierciedlają ogólne wzorce restrukturyzacji MU podczas procesu denewacji-reinnerwacji (DRP), od samego początku choroby do niemal całkowitego obumarcia mięśnia.
Wszystkie choroby neurogenne charakteryzują się śmiercią większej lub mniejszej liczby neuronów ruchowych lub ich aksonów. Przeżyte neurony ruchowe unerwiają „obce” włókna mięśniowe pozbawione kontroli nerwowej, zwiększając w ten sposób ich liczbę w ich MU. W elektromiografii proces ten objawia się stopniowym wzrostem parametrów potencjałów takiego MU. Cały cykl zmian histogramu rozkładu MU według czasu trwania w chorobach neuronalnych jest konwencjonalnie podzielony na pięć stadiów EMG, odzwierciedlających proces kompensacyjnej unerwienia w mięśniach. Chociaż taki podział jest konwencjonalny, pomaga zrozumieć i prześledzić wszystkie stadia rozwoju DRP w każdym konkretnym mięśniu, ponieważ każdy etap odzwierciedla pewną fazę reinerwacji i stopień jej nasilenia. Niewłaściwe jest przedstawianie etapu VI jako histogramu, ponieważ odzwierciedla on końcowy punkt procesu „odwrotnego”, czyli proces dekompensacji i zniszczenia MU mięśnia.
Wśród specjalistów w naszym kraju stadia te stały się powszechne w diagnostyce różnych chorób nerwowo-mięśniowych. Są one uwzględnione w programie komputerowym domowych elektromiografów, który pozwala na automatyczną budowę histogramów wskazujących stadium procesu. Zmiana stadium w jednym lub drugim kierunku podczas ponownego badania pacjenta pokazuje, jakie są dalsze perspektywy rozwoju DRP.
- Stopień I: średni czas trwania MUAP ulega skróceniu o 13-20%. Stopień ten odzwierciedla początkową fazę choroby, kiedy denewacja już się rozpoczęła, a proces reinerwacji nie ujawnia się jeszcze elektromiograficznie. Niektóre denewowane włókna mięśniowe, pozbawione wpływu impulsów z powodu patologii neuronu ruchowego lub jego aksonu, wypadają ze składu niektórych MU. Liczba włókien mięśniowych w takich MUAP maleje, co prowadzi do skrócenia czasu trwania poszczególnych potencjałów. W stopniu I pojawia się pewna liczba węższych potencjałów niż w zdrowym mięśniu, co powoduje nieznaczne skrócenie średniego czasu trwania. Histogram rozkładu MUAP zaczyna przesuwać się w lewo, w kierunku mniejszych wartości.
- Etap II: średni czas trwania MUAP jest skrócony o 21% lub więcej. W DRP etap ten obserwuje się niezwykle rzadko i tylko w przypadkach, gdy z jakiegoś powodu reinerwacja nie występuje lub jest tłumiona przez jakiś czynnik (np. alkohol, promieniowanie itp.), podczas gdy denewacja, wręcz przeciwnie, wzrasta i następuje masowa śmierć włókien mięśniowych w MUAP. Prowadzi to do tego, że większość lub prawie wszystkie MUAP stają się krótsze w czasie niż normalnie, przez co średni czas trwania nadal się zmniejsza. Histogram rozkładu MUAP przesuwa się znacząco w kierunku mniejszych wartości. Etapy I-II odzwierciedlają zmiany w MUAP spowodowane zmniejszeniem liczby funkcjonujących włókien mięśniowych w nich.
- Etap III: średni czas trwania MUAP mieści się w granicach ±20% normy dla danego mięśnia. Etap ten charakteryzuje się pojawieniem pewnej liczby potencjałów o zwiększonym czasie trwania, zwykle niewykrywalnych. Pojawienie się tych MUAP wskazuje na początek reinerwacji, tj. odnerwione włókna mięśniowe zaczynają być włączane do innych MUAP, przez co parametry ich potencjałów rosną. W mięśniu jednocześnie rejestrowane są MUAP zarówno o zmniejszonym, jak i normalnym, a także o zwiększonym czasie trwania, liczba powiększonych MUAP w mięśniu waha się od jednego do kilku. Średni czas trwania MUAP w etapie III może być prawidłowy, ale wygląd histogramu różni się od normy. Nie ma on kształtu rozkładu normalnego, ale jest „spłaszczony”, rozciągnięty i zaczyna przesuwać się w prawo, w kierunku większych wartości. Proponuje się podzielenie etapu III na dwie podgrupy - IIIA i IIIB. Różnią się one tylko tym, że w stadium IIIA średni czas trwania MUAP ulega skróceniu o 1-20%, a w stadium IIIB albo całkowicie pokrywa się ze średnią wartością normy, albo wydłuża się o 1-20%. W stadium IIIB rejestruje się nieco większą liczbę MUAP o wydłużonym czasie trwania niż w stadium IIIA. Praktyka pokazała, że taki podział trzeciego stadium na dwie podgrupy nie ma większego znaczenia. W rzeczywistości stadium III oznacza po prostu pojawienie się pierwszych objawów EMG reinerwacji w mięśniu.
- Etap IV: średni czas trwania MUAP wydłuża się o 21-40%. Etap ten charakteryzuje się wzrostem średniego czasu trwania MUAP ze względu na pojawienie się, obok normalnych MUAP, dużej liczby potencjałów o zwiększonym czasie trwania. MUAP o skróconym czasie trwania są rejestrowane na tym etapie niezwykle rzadko. Histogram jest przesunięty w prawo, w kierunku większych wartości, jego kształt jest inny i zależy od stosunku MUAP o normalnym i zwiększonym czasie trwania.
- Etap V: średni czas trwania MUAP wzrasta o 41% lub więcej. Etap ten charakteryzuje się obecnością przeważnie dużych i „olbrzymich” MUAP, podczas gdy MUAP o normalnym czasie trwania są praktycznie nieobecne. Histogram jest znacznie przesunięty w prawo, rozciągnięty i z reguły otwarty. Etap ten odzwierciedla maksymalną objętość reinerwacji w mięśniu, a także jej skuteczność: im więcej gigantycznych MUAP, tym bardziej skuteczna jest reinerwacja.
- Etap VI: średni czas trwania MUAP mieści się w granicach normy lub jest zmniejszony o ponad 12%. Etap ten charakteryzuje się obecnością MUAP (potencjałów pogarszających się MU), które są zmienione w kształcie. Ich parametry mogą być formalnie normalne lub zmniejszone, ale kształt MUAP jest zmieniony: potencjały nie mają ostrych szczytów, są rozciągnięte, zaokrąglone, czas narastania potencjału jest gwałtownie zwiększony. Etap ten obserwuje się w ostatnim etapie dekompensacji DRP, gdy większość neuronów ruchowych rdzenia kręgowego już obumarła, a reszta intensywnie obumiera. Dekompensacja procesu rozpoczyna się od momentu, gdy proces denewacji wzrasta, a źródeł unerwienia staje się coraz mniej. W EMG etap dekompensacji charakteryzuje się następującymi objawami: parametry MUAP zaczynają spadać, olbrzymie MUAP stopniowo zanikają, intensywność PF gwałtownie wzrasta, pojawiają się olbrzymie POW, co wskazuje na obumieranie wielu sąsiadujących włókien mięśniowych. Te oznaki wskazują, że w tym mięśniu neurony ruchowe wyczerpały swoje zdolności kiełkowania w wyniku niewydolności funkcjonalnej i nie są już w stanie w pełni kontrolować swoich włókien. W rezultacie liczba włókien mięśniowych w jednostce ruchowej stopniowo maleje, mechanizmy przewodzenia impulsów są zaburzone, potencjały takich jednostek ruchowych są zaokrąglone, ich amplituda maleje, a ich czas trwania maleje. Na tym etapie procesu nie jest właściwe rysowanie histogramu, ponieważ on, podobnie jak średni czas trwania PMU, nie odzwierciedla już prawdziwego stanu mięśnia. Głównym objawem etapu VI jest zmiana kształtu wszystkich PMU.
Stopnie EMG są stosowane nie tylko w przypadku chorób neurogennych, ale także w przypadku różnych pierwotnych chorób mięśni, aby scharakteryzować głębokość patologii mięśni. W tym przypadku stopień EMG odzwierciedla nie DRP, ale nasilenie patologii i jest nazywany „stopniem EMG procesu patologicznego”. W pierwotnych dystrofiach mięśniowych mogą pojawić się ostro polifazowe PMU z satelitami, które wydłużają ich czas trwania, co znacznie zwiększa jego średnią wartość, odpowiadającą III lub nawet IV stopniowi EMG procesu patologicznego.
Znaczenie diagnostyczne stadiów EMG
- W chorobach neuronalnych często stwierdza się różne stadia EMG w różnych mięśniach u tego samego pacjenta – stadia III–VI wykrywane są bardzo rzadko – na samym początku choroby i tylko w pojedynczych mięśniach.
- W chorobach aksonowych i demielinizacyjnych najczęściej wykrywane są stadia III i IV, a stadia I i II są rzadsze. Stadium V wykrywa się, gdy znaczna liczba aksonów obumiera w poszczególnych, najbardziej dotkniętych mięśniach.
- W pierwotnych chorobach mięśni dochodzi do utraty włókien mięśniowych ze składu MU z powodu pewnej patologii mięśni: zmniejszenia średnicy włókien mięśniowych, ich rozszczepienia, fragmentacji lub innego uszkodzenia, które zmniejsza liczbę włókien mięśniowych w MU lub zmniejsza objętość mięśnia. Wszystko to prowadzi do zmniejszenia (skrócenia) czasu trwania PMU. Dlatego w większości pierwotnych chorób mięśni i miastenii wykrywa się stadia I i II, w zapaleniu wielomięśniowym - początkowo tylko I i I, a po wyzdrowieniu - III, a nawet IV.
Amplituda potencjału jednostki motorycznej
Amplituda jest pomocniczym, ale bardzo ważnym parametrem w analizie MUAP. Mierzy się ją „od szczytu do szczytu”, czyli od najniższego punktu szczytu dodatniego do najwyższego punktu szczytu ujemnego. Podczas rejestrowania MUAP na ekranie ich amplituda jest określana automatycznie. Określana jest zarówno średnia, jak i maksymalna amplituda MUAP wykrytego w badanym mięśniu.
Średnie wartości amplitudy MUAP w mięśniach proksymalnych zdrowych ludzi w większości przypadków wynoszą 500-600 μV, w mięśniach dystalnych - 600-800 μV, podczas gdy maksymalna amplituda nie przekracza 1500-1700 μV. Wskaźniki te są bardzo warunkowe i mogą się w pewnym stopniu zmieniać. U dzieci w wieku 8-12 lat średnia amplituda MUAP z reguły mieści się w granicach 300-400 μV, a maksymalna nie przekracza 800 μV; u starszych dzieci wskaźniki te wynoszą odpowiednio 500 i 1000 μV. W mięśniach twarzy amplituda MUAP jest znacznie niższa.
U sportowców obserwuje się zwiększoną amplitudę MUAP w wytrenowanych mięśniach. W związku z tym wzrost średniej amplitudy MUAP w mięśniach zdrowych osób uprawiających sport nie może być uważany za patologię, ponieważ występuje w wyniku restrukturyzacji MU z powodu długotrwałego obciążenia mięśni.
We wszystkich chorobach neurogennych amplituda potencjału PMU z reguły wzrasta zgodnie ze wzrostem czasu trwania: im dłuższy czas trwania potencjału, tym większa jego amplituda.
Najbardziej znaczący wzrost amplitudy MUAP obserwuje się w chorobach neuronalnych, takich jak rdzeniowy zanik mięśni i konsekwencje polio. Stanowi on dodatkowe kryterium diagnozy neurogennej natury patologii w mięśniach. Wzrost amplitudy MUAP jest spowodowany reorganizacją MU w mięśniu, wzrostem liczby włókien mięśniowych w strefie elektrody, synchronizacją ich aktywności i wzrostem średnicy włókien mięśniowych.
Wzrost zarówno średniej, jak i maksymalnej amplitudy MUAP obserwuje się czasami w niektórych pierwotnych chorobach mięśni, takich jak zapalenie wielomięśniowe, pierwotna dystrofia mięśniowa, miotonia dystroficzna itp.
Przebieg potencjału jednostki motorycznej
Kształt PDE zależy od struktury DE, stopnia synchronizacji potencjałów jego włókien mięśniowych, położenia elektrody względem włókien mięśniowych analizowanego DE i ich stref unerwienia. Kształt potencjału nie ma wartości diagnostycznej.
W praktyce klinicznej kształt MUAP analizowany jest pod względem liczby faz i/lub obrotów potencjału. Każde dodatnio-ujemne odchylenie potencjału, które osiąga izolinę i ją przekracza, nazywane jest fazą, a dodatnio-ujemne odchylenie potencjału, które nie osiąga izoliny, nazywane jest obrotem.
Potencjał jest uważany za wielofazowy, jeśli ma pięć lub więcej faz i przecina linię osiową co najmniej cztery razy. Potencjał może mieć dodatkowe zwoje, które nie przecinają linii osiowej. Zwoje mogą znajdować się zarówno w ujemnej, jak i dodatniej części potencjału.
W mięśniach zdrowych ludzi MUAP-y są zwykle reprezentowane przez trójfazowe oscylacje potencjału, jednak przy rejestracji MUAP-u w strefie płytki końcowej może on mieć dwie fazy, tracąc swoją początkową dodatnią część.
Zwykle liczba polifazowych MUAP nie przekracza 5-15%. Wzrost liczby polifazowych MUAP jest uważany za oznakę zaburzenia w strukturze MU ze względu na obecność jakiegoś procesu patologicznego. Polifazowe i pseudopolifazowe MUAP są rejestrowane zarówno w chorobach neuronalnych i aksonalnych, jak i w pierwotnych chorobach mięśni.
 [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Aktywność spontaniczna
W normalnych warunkach, gdy elektroda jest nieruchoma w rozluźnionym mięśniu zdrowej osoby, nie występuje żadna aktywność elektryczna. W patologii pojawia się spontaniczna aktywność włókien mięśniowych lub DE. Spontaniczna aktywność nie zależy od woli pacjenta, nie może jej zatrzymać ani wywołać arbitralnie.
Spontaniczna aktywność włókien mięśniowych
Spontaniczna aktywność włókien mięśniowych obejmuje potencjały fibrylacji (FP) i dodatnie fale ostre (PSW). FP i PSB są rejestrowane wyłącznie w warunkach patologicznych, gdy do mięśnia wprowadza się koncentryczną elektrodę igłową. FP to potencjał jednego włókna mięśniowego, PSB to powolna oscylacja, która występuje po szybkim dodatnim odchyleniu, bez ostrego ujemnego szczytu. PSB odzwierciedla udział zarówno jednego, jak i kilku sąsiednich włókien.
Badanie spontanicznej aktywności włókien mięśniowych w warunkach badania klinicznego pacjenta jest najwygodniejszą metodą elektrofizjologiczną, pozwalającą ocenić stopień kompletności i stabilności oddziaływań nerwowych na włókna mięśniowe mięśnia szkieletowego w jego patologii.
Spontaniczna aktywność włókien mięśniowych może wystąpić w każdej patologii obwodowego aparatu neuromotorycznego. W chorobach neurogennych, a także w patologii synaps (miastenia i zespoły miasteniczne), spontaniczna aktywność włókien mięśniowych odzwierciedla proces ich denewacji. W większości pierwotnych chorób mięśni, spontaniczna aktywność włókien mięśniowych odzwierciedla pewne uszkodzenia włókien mięśniowych (ich rozszczepianie, fragmentację itp.), a także ich patologię wywołaną procesem zapalnym (w miopatiach zapalnych - zapalenie wielomięśniowe, zapalenie skórno-mięśniowe). W obu przypadkach PF i POV wskazują na obecność trwającego procesu w mięśniu; normalnie nigdy nie są rejestrowane.
- Czas trwania PF wynosi 1-5 ms (nie ma wartości diagnostycznej), a amplituda waha się w bardzo szerokich granicach (średnio 118±114 μV). Czasami wykrywa się również PF o wysokiej amplitudzie (do 2000 μV), zwykle u pacjentów z chorobami przewlekłymi. Czas pojawienia się PF zależy od lokalizacji uszkodzenia nerwu. W większości przypadków występują one 7-20 dni po denewacji.
- Jeśli z jakiegoś powodu nie dochodzi do reinerwacji odnerwionego włókna mięśniowego, z czasem obumiera ono, generując POW, które EMG uważa za oznakę obumarcia odnerwionego włókna mięśniowego, które nie otrzymało wcześniej utraconej inerwacji. Liczbę PF i POW zarejestrowanych w każdym mięśniu można wykorzystać do pośredniej oceny stopnia i głębokości jego odnerwienia lub objętości martwych włókien mięśniowych. Czas trwania POW wynosi od 1,5 do 70 ms (w większości przypadków do 10 ms). Tak zwane gigantyczne POW trwające ponad 20 ms wykrywa się przy przedłużonej denerwacji dużej liczby sąsiadujących włókien mięśniowych, a także przy zapaleniu wielomięśniowym. Amplituda POW zwykle waha się między 10 a 1800 μV. POW o dużej amplitudzie i czasie trwania są częściej wykrywane w późniejszych stadiach denerwacji („gigantyczne” POW). Pierwsze objawy POV rejestruje się 16–30 dni po pierwszym pojawieniu się PF; mogą one utrzymywać się w mięśniu przez kilka lat po denewacji. Z reguły objawy POV wykrywa się później u pacjentów z zapalnymi zmianami nerwów obwodowych niż u pacjentów z urazowymi zmianami.
PF i POV najszybciej reagują na rozpoczęcie terapii: jeśli jest ona skuteczna, nasilenie PF i POV zmniejsza się po 2 tygodniach. Natomiast jeśli leczenie jest nieskuteczne lub niewystarczająco skuteczne, ich nasilenie wzrasta, co pozwala na wykorzystanie analizy PF i POV jako wskaźnika skuteczności stosowanych leków.
Wyładowania miotoniczne i pseudomiotoniczne
Wyładowania miotoniczne i pseudomiotoniczne, czyli wyładowania o wysokiej częstotliwości, odnoszą się również do spontanicznej aktywności włókien mięśniowych. Wyładowania miotoniczne i pseudomiotoniczne różnią się szeregiem cech, z których główną jest wysoka powtarzalność elementów tworzących wyładowanie, tj. wysoka częstotliwość potencjałów w wyładowaniu. Termin „wyładowanie pseudomiotoniczne” jest coraz częściej zastępowany terminem „wyładowanie o wysokiej częstotliwości”.
- Wyładowania miotoniczne to zjawisko wykrywane u pacjentów z różnymi formami miotonii. Podczas słuchania przypomina dźwięk „bombowca nurkującego”. Na ekranie monitora wyładowania te wyglądają jak powtarzające się potencjały o stopniowo zmniejszającej się amplitudzie, z stopniowo zwiększającymi się interwałami (co powoduje obniżenie wysokości dźwięku). Wyładowania miotoniczne są czasami obserwowane w niektórych formach patologii endokrynologicznej (na przykład niedoczynności tarczycy). Wyładowania miotoniczne występują albo spontanicznie, albo po niewielkim skurczu lub mechanicznym podrażnieniu mięśnia za pomocą elektrody igłowej włożonej do niego lub po prostu przez opukiwanie mięśnia.
- Wyładowania pseudomiotoniczne (wyładowania o wysokiej częstotliwości) są rejestrowane w niektórych chorobach nerwowo-mięśniowych, zarówno związanych, jak i niezwiązanych z denewacją włókien mięśniowych. Uważa się je za konsekwencję efaptycznego przekazywania pobudzenia ze spadkiem właściwości izolacyjnych błony włókien mięśniowych, co stwarza przesłankę do rozprzestrzeniania się pobudzenia z jednego włókna na sąsiednie: rozrusznik jednego z włókien ustala rytm impulsów, który jest narzucany na sąsiednie włókna, co powoduje unikalny kształt kompleksów. Wyładowania zaczynają się i kończą nagle. Ich główną różnicą od wyładowań miotonicznych jest brak spadku amplitudy składowych. Wyładowania pseudomiotoniczne obserwuje się w różnych postaciach miopatii, zapaleniu wielomięśniowym, zespołach denewacji (w późnych stadiach reinerwacji), zanikach rdzeniowych i nerwowych (choroba Charcota-Mariego-Tootha), patologii endokrynologicznej, urazach lub ucisku nerwu i niektórych innych chorobach.
Spontaniczna aktywność jednostki motorycznej
Spontaniczna aktywność jednostki ruchowej jest reprezentowana przez potencjały pęczkowe. Fascykulacje to spontaniczne skurcze całej jednostki ruchowej, które występują w całkowicie rozluźnionym mięśniu. Ich występowanie jest związane z chorobami neuronu ruchowego, jego przeciążeniem włóknami mięśniowymi, podrażnieniem któregokolwiek z jego odcinków oraz restrukturyzacją funkcjonalną i morfologiczną.
Pojawienie się wielu potencjałów fascykulacyjnych w mięśniach jest uważane za jeden z głównych objawów uszkodzenia neuronów ruchowych rdzenia kręgowego. Wyjątkiem są „łagodne” potencjały fascykulacyjne, czasami wykrywane u pacjentów, którzy skarżą się na ciągłe drganie mięśni, ale nie zauważają osłabienia mięśni ani innych objawów.
Pojedyncze potencjały pęczkowe można wykryć również w chorobach neurogennych, a nawet pierwotnych chorobach mięśni, takich jak miotonia, zapalenie wielomięśniowe, miopatie endokrynologiczne, metaboliczne i mitochondrialne.
Opisano potencjały fascykulacyjne występujące u wysoko wykwalifikowanych sportowców po wyczerpującym wysiłku fizycznym. Mogą one również występować u zdrowych, ale łatwo pobudliwych osób, u pacjentów z zespołami cieśni, polineuropatią i u osób starszych. Jednak w przeciwieństwie do chorób neuronów ruchowych ich liczba w mięśniu jest bardzo mała, a parametry są zwykle prawidłowe.
Parametry potencjałów fascykulacyjnych (amplituda i czas trwania) odpowiadają parametrom MUAP rejestrowanym w danym mięśniu i mogą zmieniać się równolegle ze zmianami MUAP w trakcie rozwoju choroby.
Elektromiografia igłowa w diagnostyce chorób neuronów ruchowych rdzenia kręgowego i nerwów obwodowych
Każdej patologii neurogennej towarzyszy DRP, którego nasilenie zależy od stopnia uszkodzenia źródeł unerwienia i od poziomu obwodowego aparatu neuromotorycznego – neuronalnego lub aksonowego – na którym nastąpiło uszkodzenie. W obu przypadkach utracona funkcja zostaje przywrócona dzięki ocalałym włóknom nerwowym, a te ostatnie zaczynają się intensywnie rozgałęziać, tworząc liczne pędy skierowane do odnerwionych włókien mięśniowych. To rozgałęzienie otrzymało w literaturze nazwę „kiełkowania”.
Istnieją dwa główne typy kiełkowania - poboczne i końcowe. Kiełkowanie poboczne to rozgałęzienie aksonów w obszarze węzłów Ranviera, kiełkowanie końcowe to rozgałęzienie końcowej, niezmielinizowanej części aksonu. Wykazano, że charakter kiełkowania zależy od charakteru czynnika, który spowodował zaburzenie kontroli nerwowej. Na przykład w przypadku zatrucia botulinowego rozgałęzienie występuje wyłącznie w strefie końcowej, a w przypadku chirurgicznego odnerwienia występuje zarówno kiełkowanie końcowe, jak i poboczne.
W elektromiografii te stany MU na różnych etapach procesu reinerwacji charakteryzują się pojawieniem się MUAP o zwiększonej amplitudzie i czasie trwania. Wyjątkiem są bardzo początkowe stadia formy opuszkowej SLA, w których parametry MUAP przez kilka miesięcy mieszczą się w granicach normalnych wahań.
Kryteria elektromiograficzne chorób neuronów ruchowych rdzenia kręgowego
- Obecność wyraźnych potencjałów fascykulacyjnych (główne kryterium uszkodzenia neuronów ruchowych rdzenia kręgowego).
- Wzrost parametrów PDE i ich polifazowości, odzwierciedlający nasilenie procesu reinerwacji.
- Pojawienie się spontanicznej aktywności włókien mięśniowych w mięśniach PF i POV, świadczące o zachodzącym procesie denewacji.
Potencjały fascykulacyjne są obowiązkowym elektrofizjologicznym objawem uszkodzenia neuronów ruchowych rdzenia kręgowego. Wykrywa się je już na najwcześniejszych etapach procesu patologicznego, jeszcze przed pojawieniem się objawów denewacji.
Ponieważ choroby neuronowe oznaczają ciągły proces denewacji i reinerwacji, gdy duża liczba neuronów ruchowych obumiera, a jednocześnie niszczona jest odpowiednia liczba MU, MU stają się coraz większe, ich czas trwania i amplituda wzrastają. Stopień wzrostu zależy od czasu trwania i stadium choroby.
Nasilenie PF i POV zależy od nasilenia procesu patologicznego i stopnia denewacji mięśni. W szybko postępujących chorobach (np. ALS) PF i POV występują w większości mięśni, w chorobach wolno postępujących (niektóre formy zaników rdzeniowych) – tylko w połowie mięśni, a w zespole post-poliomyelitis – w mniej niż jednej trzeciej.
Kryteria elektromiograficzne chorób aksonów nerwów obwodowych
Elektromiografia igłowa w diagnostyce chorób nerwów obwodowych jest dodatkową, ale konieczną metodą badania, która określa stopień uszkodzenia mięśnia unerwionego przez zaatakowany nerw. Badanie pozwala na wyjaśnienie obecności objawów denewacji (SF), stopnia zaniku włókien mięśniowych w mięśniu (całkowitej liczby MUF i obecności olbrzymich MUF), nasilenia reinerwacji i jej skuteczności (stopnia wzrostu parametrów MUF, maksymalnej amplitudy MUF w mięśniu).
Główne objawy elektromiograficzne wyrostka aksonowego:
- wzrost średniej wartości amplitudy PDE;
- obecność PF i POV (z obecnym odnerwieniem);
- wydłużenie czasu trwania PDE (średnia wartość może mieścić się w granicach normy, tj. ±12%);
- polifazja PDE;
- pojedyncze potencjały pęczkowe (nie w każdym mięśniu).
W przypadku uszkodzenia aksonów nerwów obwodowych (różne polineuropatie) występuje również DRP, ale jego nasilenie jest znacznie mniejsze niż w chorobach neuronalnych. W konsekwencji MUAP wzrasta w znacznie mniejszym stopniu. Niemniej jednak podstawowa zasada zmiany MUAP w chorobach neurogennych dotyczy również uszkodzeń aksonów nerwów ruchowych (tj. stopień wzrostu parametrów MUAP i ich polifazowość zależą od stopnia uszkodzenia nerwu i nasilenia reinerwacji). Wyjątkiem są stany patologiczne, którym towarzyszy szybkie obumieranie aksonów nerwów ruchowych z powodu urazu (lub innego stanu patologicznego prowadzącego do obumierania dużej liczby aksonów). W tym przypadku pojawiają się te same olbrzymie MUAP (o amplitudzie ponad 5000 μV) co w chorobach neuronalnych. Takie MUAP obserwuje się w długotrwałych postaciach patologii aksonowej, CIDP, zanikach nerwowych.
Jeśli w polineuropatiach aksonalnych w pierwszej kolejności wzrasta amplituda MUAP, to w procesie demielinizacyjnym wraz z pogorszeniem stanu czynnościowego mięśnia (zmniejszeniem jego siły) średnie wartości czasu trwania MUAP stopniowo wzrastają; istotnie częściej niż w procesie aksonalnym wykrywa się polifazowe MUAP i potencjały pęczkowe, a rzadziej PF i POV.
 [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ], [ 42 ]
[ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ], [ 42 ]
Elektromiografia igłowa w diagnostyce chorób synaptycznych i pierwotnych chorób mięśniowych
Choroby synaptyczne i pierwotne mięśniowe zwykle mają skrócony średni czas trwania MUAP. Stopień skrócenia czasu trwania MUAP koreluje ze spadkiem siły. W niektórych przypadkach parametry MUAP mieszczą się w zakresie normy, a w PMD mogą być nawet podwyższone.

