Ekspert medyczny artykułu
Nowe publikacje
Zespół Goodpasture'a: przyczyny, objawy, diagnoza, leczenie
Ostatnia recenzja: 12.07.2025

Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
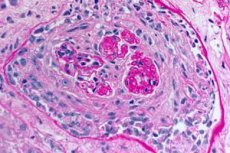
Zespół Goodpasture'a to zespół autoimmunologiczny obejmujący krwotok pęcherzykowy i kłębuszkowe zapalenie nerek wywołane przez krążące przeciwciała anty-GBM. Zespół Goodpasture'a najczęściej rozwija się u osób z predyspozycjami genetycznymi, które palą papierosy, ale wdychanie węglowodorów i wirusowe infekcje dróg oddechowych są możliwymi dodatkowymi czynnikami. Objawy zespołu Goodpasture'a obejmują duszność, kaszel, zmęczenie, krwioplucie i/lub krwiomocz. Zespół Goodpasture'a podejrzewa się u pacjentów z krwiopluciem lub krwiomoczem i potwierdza się go obecnością przeciwciał anty-GBM we krwi. Leczenie zespołu Goodpasture'a obejmuje wymianę osocza, glikokortykoidy i leki immunosupresyjne, takie jak cyklofosfamid. Rokowanie jest dobre, jeśli leczenie zostanie rozpoczęte przed rozwojem niewydolności oddechowej lub nerek.
Zespół Goodpasture'a został po raz pierwszy opisany przez Goodpasture'a w 1919 roku. Zespół Goodpasture'a to połączenie kłębuszkowego zapalenia nerek i krwotoku pęcherzykowego w obecności przeciwciał anty-GBM. Zespół Goodpasture'a najczęściej objawia się jako połączenie rozlanego krwotoku pęcherzykowego i kłębuszkowego zapalenia nerek, ale czasami powoduje izolowane kłębuszkowe zapalenie nerek (10-20%) lub zajęcie płuc (10%). Mężczyźni chorują częściej niż kobiety.
Co jest przyczyną zespołu Goodpasture'a?
Przyczyna choroby nie została dokładnie ustalona. Zakłada się genetyczną predyspozycję do zespołu Goodpasture'a, za jej marker uważa się obecność HLA-DRW2. Istnieje pogląd na możliwą rolę wcześniejszej infekcji wirusowej (wirus zapalenia wątroby typu A i inne choroby wirusowe), zagrożeń przemysłowych i leków (głównie D-penicylaminy).
Podstawą patogenezy zespołu Goodpasture'a jest powstawanie autoprzeciwciał przeciwko błonom podstawnym naczyń włosowatych kłębuszków nerkowych nerek i pęcherzyków płucnych. Przeciwciała te należą do klasy IgG, wiążą się z przeciwciałami błon podstawnych w obecności składnika C3 dopełniacza, co powoduje rozwój zapalenia immunologicznego nerek i pęcherzyków płucnych.
Przeciwciała anty-GBM są skierowane przeciwko niekolagenowej (NC-1) domenie 3 łańcucha kolagenu typu IV, która występuje w najwyższym stężeniu w błonach podstawnych naczyń włosowatych nerek i płuc. Narażenie na czynniki środowiskowe - palenie, wirusowe ARI i wdychanie zawiesin węglowodorów (częściej) - i, rzadziej, zapalenie płuc aktywuje prezentację antygenów naczyń włosowatych pęcherzyków płucnych krążącym przeciwciałom u osób z dziedziczną predyspozycją (najczęściej są to nosiciele alleli HLA-DRwl5, -DR4 i -DRB1). Krążące przeciwciała anty-GBM wiążą się z błonami podstawnymi, wiążą dopełniacz i indukują komórkową odpowiedź zapalną, co prowadzi do rozwoju kłębuszkowego zapalenia nerek i/lub zapalenia naczyń włosowatych płuc.
Prawdopodobnie istnieje pewna wspólnota autoantygenów błony podstawnej naczyń włosowatych kłębuszków nerkowych i pęcherzyków płucnych. Autoantygen powstaje pod wpływem szkodliwego działania czynnika etiologicznego. Nieznany czynnik etiologiczny uszkadza i modyfikuje strukturę błon podstawnych nerek i płuc. Wydalanie powstałych produktów degradacji błon podstawnych kłębuszków nerkowych spowalnia i zmniejsza się, gdy są uszkodzone, co naturalnie stwarza przesłanki do rozwoju autoimmunologicznego uszkodzenia nerek i płuc. Nadal nie wiadomo do końca, który składnik błony podstawnej staje się autoantygenem. Obecnie przyjmuje się, że jest to wewnętrzny składnik strukturalny błony podstawnej kłębuszków nerkowych, łańcuch a3 kolagenu typu 4.
Utworzone kompleksy immunologiczne odkładają się wzdłuż błon podstawnych naczyń włosowatych kłębuszków nerkowych, co prowadzi do rozwoju immunologicznego procesu zapalnego w kłębuszkach nerkowych (kłębuszkowe zapalenie nerek) i pęcherzykach płucnych (alveolitis). Głównymi komórkami zaangażowanymi w rozwój tego immunologicznego stanu zapalnego są limfocyty T, monocyty, śródbłonki, leukocyty polimorfonuklearne, makrofagi pęcherzykowe. Interakcję między nimi zapewniają mediatory molekularne, cytokiny (czynniki wzrostu - płytkowe, insulinopodobne, b-transformujące; interleukina-1, czynnik martwicy nowotworu itp.). Metabolity kwasu arachidonowego, wolne rodniki tlenowe, enzymy proteolityczne, cząsteczki adhezyjne odgrywają główną rolę w rozwoju immunologicznego stanu zapalnego.
Aktywacja makrofagów pęcherzykowych ma ogromne znaczenie w rozwoju zapalenia pęcherzyków płucnych w zespole Goodpasture'a. W stanie aktywowanym wydzielają one około 40 cytokin. Cytokiny grupy I (chemotaksyny, leukotrieny, interleukina-8) zwiększają przepływ leukocytów polimorfonuklearnych do płuc. Cytokiny grupy II (czynniki wzrostu - płytkowe, makrofagowe) promują przemieszczanie się fibroblastów do płuc. Makrofagi pęcherzykowe wytwarzają również aktywne formy tlenu, proteazy, które uszkadzają tkankę płucną.
Patomorfologia zespołu Goodpasture'a
Główne objawy patomorfologiczne zespołu Goodpasture'a to:
- przeważające uszkodzenie łożyska mikrokrążenia nerek i płuc. W płucach obserwuje się obraz zapalenia żył, tętniczek, naczyń włosowatych z wyraźnymi zjawiskami zniszczenia i proliferacji; uszkodzenie naczyń włosowatych obserwuje się głównie w przegrodach międzypęcherzykowych, rozwija się zapalenie pęcherzyków płucnych z wysiękiem krwotocznym w pęcherzykach. Uszkodzenie nerek charakteryzuje się rozwojem pozawłośniczkowego kłębuszkowego zapalenia nerek z następowym powstawaniem hialinozy i włóknienia, co prowadzi do rozwoju niewydolności nerek;
- wyraźne krwawienia wewnątrzpęcherzykowe;
- rozwój hemosyderozy płucnej i pneumosklerozy o różnym stopniu nasilenia, w wyniku rozwoju zapalenia pęcherzyków płucnych.
Objawy zespołu Goodpasture'a
Choroba najczęściej objawia się klinicznymi objawami patologii płuc. Najbardziej widocznym objawem jest krwioplucie; jednakże krwioplucie może być nieobecne w obecności objawów krwotocznych, a pacjent może mieć jedynie zmiany naciekowe na zdjęciu rentgenowskim klatki piersiowej lub naciek i niewydolność oddechową i/lub niewydolność. Duszność (głównie podczas wysiłku), kaszel, złe samopoczucie, zmniejszona zdolność do pracy, ból w klatce piersiowej, gorączka i utrata masy ciała są powszechne. Do 40% pacjentów ma makrohematurię, chociaż krwotok płucny może poprzedzać objawy nerkowe o tygodnie lub lata.
Podczas krwioplucia może wzrosnąć duszność. Osłabienie i zmniejszona zdolność do pracy są również powodem do obaw.
Objawy zespołu Goodpasture'a zmieniają się w czasie, od czystych płuc przy osłuchiwaniu do trzaskających i suchych rzężeń. Niektórzy pacjenci mają obrzęk obwodowy i bladość z powodu anemii.
Podczas badania zwraca się uwagę na bladą skórę, sinicę błon śluzowych, pastowatość lub wyraźny obrzęk twarzy, zmniejszoną siłę mięśni i utratę wagi. Temperatura ciała jest zwykle podwyższona do poziomu gorączkowego.
Podczas opukiwania płuc można stwierdzić skrócenie dźwięku opukiwania nad rozległymi ogniskami krwotoku płucnego, ale jest to obserwowane rzadko; częściej nie obserwuje się zmian w dźwięku opukiwania.
Charakterystycznym objawem osłuchowym zespołu Goodpasture'a jest suchy i mokry świszczący oddech, którego częstość znacznie wzrasta w trakcie lub po krwiopluciu.
Podczas badania układu sercowo-naczyniowego ujawnia się nadciśnienie tętnicze, ewentualnie wzrost granicy względnej tępości serca w lewo, stłumione tony serca, miękki szmer skurczowy, a wraz z rozwojem ciężkiej niewydolności nerek pojawia się szmer tarcia osierdziowego. Przy postępującym uszkodzeniu nerek na tle znacznego nadciśnienia tętniczego może rozwinąć się ostra niewydolność lewej komory z obrazem astmy sercowej i obrzęku płuc. Zwykle sytuacja ta rozwija się w terminalnym stadium choroby.
Z reguły uszkodzenie nerek ujawnia się później, po pewnym czasie od wystąpienia objawów płucnych. Charakterystycznymi objawami klinicznymi patologii nerek są krwiomocz (czasem makrohematuria), szybko postępująca niewydolność nerek, skąpomocz, nadciśnienie tętnicze.
W 10-15% przypadków zespół Goodpasture'a rozpoczyna się od objawów klinicznych patologii nerek - pojawia się obraz kliniczny kłębuszkowego zapalenia nerek (skąpomocz, obrzęk, nadciśnienie tętnicze, wyraźna bladość), a następnie dołączają się objawy uszkodzenia płuc. U wielu pacjentów mogą wystąpić bóle mięśni, bóle stawów.
Niezależnie od wariantów początkowych, zespół Goodpasture'a w większości przypadków jest ciężki, choroba stale postępuje, rozwija się ciężka niewydolność płuc i nerek. Oczekiwana długość życia pacjentów od początku choroby waha się od kilku miesięcy do 1-3 lat. Najczęściej pacjenci umierają z powodu mocznicy lub krwotoku płucnego.
Co Cię dręczy?
Diagnoza zespołu Goodpasture’a
Rozpoznanie zespołu Goodpasture wymaga wykrycia przeciwciał anty-GBM w surowicy metodą pośredniej immunofluorescencji lub, jeśli jest dostępna, metodą bezpośredniego testu immunoenzymatycznego (ELISA) z rekombinowanym ludzkim NC-1 a3. Inne testy serologiczne, takie jak badanie przeciwciał przeciwjądrowych (ANA), są stosowane do wykrywania SLE, a miano antystreptolizyny-O do wykrywania kłębuszkowego zapalenia nerek po paciorkowcach, które może być przyczyną wielu przypadków zespołu płucno-nerkowego. ANCA jest dodatnie (w próbkach obwodowych) w 25% przypadków zespołu Goodpasture'a. Biopsja nerek może być wskazana, jeśli występuje kłębuszkowe zapalenie nerek (krwiomocz, białkomocz, osad czerwonych krwinek w badaniu moczu i/lub niewydolność nerek). Szybko postępujące ogniskowe segmentowe martwicze kłębuszkowe zapalenie nerek o postępującym przebiegu jest stwierdzane w biopsji w zespole Goodpasture'a i wszystkich innych przyczynach zespołu płucno-nerkowego. Barwienie immunofluorescencyjne tkanki nerkowej lub płucnej klasycznie ujawnia liniowe odkładanie się IgG wzdłuż naczyń włosowatych kłębuszków nerkowych lub pęcherzykowych. Występuje również w przypadku cukrzycowej nerki i włóknistego kłębuszkowego zapalenia nerek, rzadkiego zaburzenia powodującego zespół płucno-nerkowy, ale wykrywanie przeciwciał GBM w tych zaburzeniach jest niespecyficzne.
Badania czynnościowe płuc i płukanie oskrzelowo-pęcherzykowe nie są diagnostyczne dla zespołu Goodpasture'a, ale mogą być stosowane w celu potwierdzenia obecności rozlanego krwotoku pęcherzykowego u pacjentów z kłębuszkowym zapaleniem nerek i naciekami płucnymi, ale bez krwioplucia. Płyn z płukania, który pozostaje krwotoczny po wielokrotnym płukaniu, może potwierdzić rozlany zespół krwotoczny, szczególnie jeśli występuje równoczesny spadek hematokrytu.
 [ 3 ]
[ 3 ]
Diagnostyka laboratoryjna zespołu Goodpasture’a
- Ogólna analiza krwi. Charakterystyczne cechy to niedokrwistość niedobarwliwa z niedoboru żelaza, niedobarwliwość, anizocytoza, poikilocytoza erytrocytów. Obserwuje się również leukocytozę, przesunięcie w lewo wzoru leukocytów i znaczny wzrost OB.
- Ogólna analiza moczu. W moczu stwierdza się białko (stopień białkomoczu może być znaczny), cylindry (ziarniste, szkliste, erytrocytowe), erytrocyty (może wystąpić makrohematuria). W miarę postępu przewlekłej niewydolności nerek zmniejsza się względna gęstość moczu, a w teście Zimnitsky'ego rozwija się izohyposthenuria.
- Badanie biochemiczne krwi. Podwyższone stężenie mocznika, kreatyniny, haptoglobiny, seromukoidu, a2 i gamma globulin we krwi, obniżona zawartość żelaza.
- Badania immunologiczne. Można wykryć spadek liczby supresorów limfocytów T, wykrywa się krążące kompleksy immunologiczne. Przeciwciała przeciwko błonie podstawnej naczyń włosowatych kłębuszków nerkowych i pęcherzyków płucnych wykrywa się metodą pośredniej immunofluorescencji lub radioimmunologiczną.
- Badanie plwociny. Plwocina zawiera dużo erytrocytów, wykryto hemosyderynę, syderofagi.
Diagnostyka instrumentalna zespołu Goodpasture’a
- Badanie rentgenowskie płuc. Charakterystycznymi objawami rentgenowskimi są nacieki płucne w okolicy korzeniowej rozprzestrzeniające się na dolne i środkowe partie płuc, a także postępujące, symetryczne, obustronne nacieki przypominające chmurę.
- Badanie funkcji oddychania zewnętrznego. Spirometria ujawnia typ restrykcyjny niewydolności oddechowej (obniżona pojemność życiowa), w miarę postępu choroby dołącza się typ obturacyjny niewydolności oddechowej (obniżona FEV1, wskaźnik Tiffeneau).
- EKG. Ujawniają się objawy ciężkiej dystrofii mięśnia sercowego o genezie anemicznej i niedotlenionej (zmniejszenie amplitudy załamków T i odstępu ST w wielu odprowadzeniach, najczęściej w odprowadzeniach lewej klatki piersiowej). Przy ciężkim nadciśnieniu tętniczym pojawiają się objawy przerostu mięśnia sercowego lewej komory.
- Badanie gazometrii krwi ujawnia niedotlenienie tętnicze.
- Badanie biopsji płuc i nerek. Biopsja tkanki płucnej (biopsja otwarta) i nerek jest wykonywana w celu ostatecznej weryfikacji rozpoznania, jeśli nie można dokładnie zdiagnozować choroby za pomocą metod nieinwazyjnych. Przeprowadza się badanie histologiczne i immunologiczne biopsji. Następujące objawy są charakterystyczne dla zespołu Goodpasture'a:
- obecność morfologicznych objawów kłębuszkowego zapalenia nerek (najczęściej pozawłośniczkowego), krwotocznego zapalenia pęcherzyków płucnych, hemosyderozy i włóknienia śródmiąższowego;
- wykrywanie liniowych złogów IgG i składnika dopełniacza C3 na błonach podstawnych pęcherzyków płucnych i kłębuszków nerkowych metodą immunofluorescencyjną.
Kryteria diagnostyczne zespołu Goodpasture’a
Przy diagnozowaniu zespołu Goodpasture'a wskazane jest zastosowanie następujących kryteriów.
- Połączenie patologii płuc i nerek, tj. krwioplucie (często krwotok płucny), duszność i objawy kłębuszkowego zapalenia nerek.
- Ciągły postępujący przebieg choroby z rozwojem niewydolności oddechowej i nerek.
- Rozwój niedokrwistości z niedoboru żelaza.
- Wykrycie w badaniu radiologicznym płuc licznych obustronnych nacieków o charakterze chmur na tle siateczkowatego odkształcenia obrazu płucnego.
- Wykrycie we krwi wysokiego miana krążących przeciwciał przeciwko błonie podstawnej kłębuszków nerkowych i pęcherzyków nerkowych.
- Wykrywanie liniowych złogów IgG i składnika dopełniacza C3 na błonach podstawnych naczyń włosowatych kłębuszków nerkowych i pęcherzyków płucnych.
- Brak innych ogólnoustrojowych objawów (oprócz płucnych i nerkowych).
Diagnostyka różnicowa zespołu Goodpasture’a
Zespół Goodpasture'a należy różnicować z szeregiem chorób objawiających się krwiopluciem lub krwotokiem płucnym. Należy wykluczyć choroby onkologiczne oskrzeli i płuc, gruźlicę, ropnie płuc, rozstrzenie oskrzeli, choroby serca i naczyń (prowadzące do przekrwienia i nadciśnienia w krążeniu płucnym), układowe zapalenie naczyń, skazę krwotoczną.
Program badań przesiewowych w kierunku zespołu Goodpasture'a
- Ogólne badania krwi i moczu.
- Badania biochemiczne krwi: oznaczenie białka całkowitego i frakcji białkowych, kreatyniny i mocznika, aminotransferaz, seromukoidów, haptoglobiny, fibryny, żelaza.
- Badanie plwociny: badanie cytologiczne, oznaczanie syderofagów.
- Badania immunologiczne: oznaczanie zawartości limfocytów B i T, subpopulacji limfocytów T, immunoglobulin, krążących kompleksów immunologicznych, przeciwciał przeciwko błonom podstawnym kłębuszków nerkowych i pęcherzyków płucnych.
- Badanie rentgenowskie płuc.
- EKG.
- Spirometria.
- Badanie biopsji płuc i nerek.
Jakie testy są potrzebne?
Leczenie zespołu Goodpasture'a
Leczenie zespołu Goodpasture'a obejmuje codzienną lub co drugą dobę wymianę osocza przez 2 do 3 tygodni (4 L wymiany osocza) w celu usunięcia przeciwciał anty-GBM, w połączeniu z dożylnymi glikokortykosteroidami (zwykle metyloprednizolon 1 g przez co najmniej 20 minut co drugi dzień 3 razy z prednizolonem 1 mg/kg masy ciała dziennie) i cyklofosfamidem (2 mg/kg raz dziennie) przez 6 do 12 miesięcy w celu zapobiegania tworzeniu się nowych przeciwciał. Terapia może być stopniowo zmniejszana, gdy czynność płuc i nerek przestaje się poprawiać. Długoterminowa śmiertelność jest związana ze stopniem upośledzenia czynności nerek na początku choroby; pacjenci wymagający wczesnej dializy i ci, u których biopsja wykazała ponad 50% nefronów półksiężycowatych, mają czas przeżycia krótszy niż 2 lata i często wymagają dializy, chyba że rozważa się przeszczep nerki. Krwioplucie może być dobrym objawem prognostycznym, ponieważ prowadzi do wcześniejszego wykrycia choroby; mniejszość pacjentów, u których występują przeciwciała ANCA-dodatnie, lepiej reaguje na leczenie zespołu Goodpasture'a. Nawrót choroby występuje w niewielkim procencie przypadków i jest związany z ciągłym paleniem tytoniu i infekcją dróg oddechowych. U pacjentów z chorobą nerek w stadium końcowym, którzy przeszli przeszczep nerki, choroba może powrócić w przeszczepie.
Jakie są rokowania w przypadku zespołu Goodpasture'a?
Zespół Goodpasture’a często postępuje szybko i może zakończyć się zgonem, jeżeli nie zostanie szybko zdiagnozowany i leczony; rokowanie jest dobre, jeżeli leczenie zostanie rozpoczęte przed rozwinięciem się niewydolności oddechowej lub nerek.
Natychmiastowe przeżycie w przypadku krwotoku płucnego i niewydolności oddechowej wiąże się z zapewnieniem drożności dróg oddechowych; intubację dotchawiczą i wentylację mechaniczną zaleca się u pacjentów z granicznymi poziomami gazów we krwi tętniczej i zbliżającą się niewydolnością oddechową.

